网址:http://m.1010jiajiao.com/timu3_id_43463[举报]
“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ?mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ?mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ?mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ?mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg ![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO ![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO ![]() 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
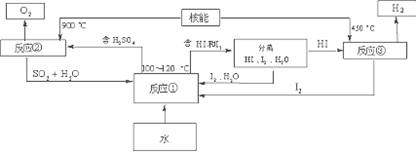
请写出反应①的化学方程式: ;
该法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
查看习题详情和答案>>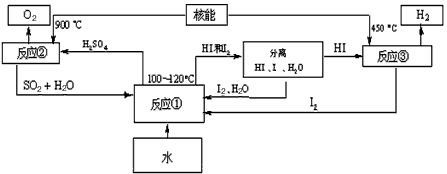
“氢能”将是未来最理想的新能源。实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________________________。(填序号)
A.2H2(g)+O2(g) ![]() 2H2O(l); △H=-142.9kJ?mol―1
2H2O(l); △H=-142.9kJ?mol―1
B.H2(g)+![]() O2(g)
O2(g) ![]() H2O(l); △H=-285.8kJ?mol―1
H2O(l); △H=-285.8kJ?mol―1
C.2H2+O2![]() 2H2O(l); △H=-571.6kJ?mol―1
2H2O(l); △H=-571.6kJ?mol―1
D.H2(g)+![]() O2(g)
O2(g) ![]() H2O(g); △H=-285.8kJ?mol―1
H2O(g); △H=-285.8kJ?mol―1
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为:
___________________________
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2 ③HgBr2+CaO
 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑ 你认为该方法的主要缺点是____________________________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实?__________(填“不现实”或“现实”),说明能够支持你的观点的两点理由:______________________;____________________。
(5)实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾
(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。制备皓矾的实验流程如下图所示。

Fe(OH)3:2.7~3.7 Fe(OH)2:7.6~9.6 Zn(OH)2:5.7~8.0
试回答下列问题:
①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
______,其理由是____________。
②加入试剂的②,供选择使用的有:Zn粉、ZnO、Zn(OH)2、Zn2CO3、ZnSO4等,应选用____________,其理由是______________。
③在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是_____________________。
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。
A. 2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B. H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C. 2H2+O2=2H2O(l) △H=-571.6 kJ/mol
D. H2(g)+1/2O2(g)=H2O(g) △H=-285.8 kJ/mol
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O
 CaO+2HBr
CaO+2HBr②2HBr+Hg
 HgBr2+H2
HgBr2+H2 ③HgBr2+_____
 ______
______ ④2HgO2
 Hg+O2↑
Hg+O2↑ 请你根据“原子经济”的思想完成上述步骤③的化学方程式:__________________。根据“绿色化学”的思想评估该方法制H2的主要缺点:_______。
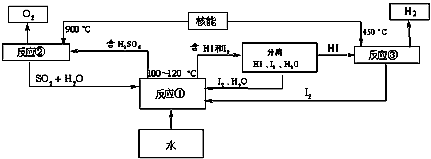
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O) 完成下列反应的化学方程式:
反应①_______________;反应②_____________。此法制取氢气的最大优点是__________________

 CO2(g)+H2(g) △H<0 在850℃时,
CO2(g)+H2(g) △H<0 在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K_____(填“大于”“小于”或“等 于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、 1.0 molCO2和xmol H2,则 ①当x=5.0时,上述平衡向_____(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_____(填“大于”“小 于”或“等于”)b。
V.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O 在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8 g,其中含单质铜与氧化亚铜的物质的量之比是_____;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体_______g;
(3)若将6 8 g上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1. 568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分
是_______,其物质的量之比是_______;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤出来,得晶体23. 68 g。经分析,原溶液中的Cu2+有
20%残留在母液中。求所得晶体的化学式:_______。
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2↑ ③HgBr2+CaO
HgBr2+H2↑ ③HgBr2+CaO HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑ 上述过程的总反应可表示为__________________________。
2Hg+O2↑ 上述过程的总反应可表示为__________________________。