网址:http://m.1010jiajiao.com/timu3_id_434625[举报]
| A、0.1mol/L | B、0.2mol/L | C、0.3mol/L | D、0.4mol/L |
(15分)
实验室通过实验测定NaOH溶液和盐酸反应的中和热.实验需用约450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一个)
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在 (填实验用品或仪器的名称),用托盘天平 g NaOH固体.在使用容量瓶前必须进行的操作是 .
(2)下列操作会使所配溶液的浓度偏高的是(填序号) .
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线.
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是 . 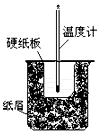
(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为 .
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为 (填字母).
A.a>b>c B.b>c>a C.a="b=c " D.无法比较
