摘要:2.后期限制空气流入的量.是否必要?为什么?
网址:http://m.1010jiajiao.com/timu3_id_434577[举报]
铬在很多领域有较大用途。铬化合物中,Cr(Ⅵ)主要以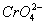 (溶液为黄色)和
(溶液为黄色)和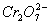 (溶液为红色)形态存在,在酸性条件下具有很强的氧化性,能被还原剂还原成Cr3+(溶液为紫色);Cr(Ⅵ)化合物水溶性很强,而Cr(Ⅲ)化合物水溶性很低。试回答下列问题:
(溶液为红色)形态存在,在酸性条件下具有很强的氧化性,能被还原剂还原成Cr3+(溶液为紫色);Cr(Ⅵ)化合物水溶性很强,而Cr(Ⅲ)化合物水溶性很低。试回答下列问题:
(1)用K2Cr2O7可以制备检验司机是否酒后开车的装置。现象是_______________________。
另一方面,铬对环境造成污染。其中,Cr(Ⅵ)的毒性比Cr(Ⅲ)毒性强200倍。制革厂排放的污染中约有1/3是有机物,其余是大量的含铬物质,直接排放污泥会对环境造成污染。1996年,外国科学家研究成功了一种技术,它较好地解决了制革厂废物利用与环境保护问题。工艺流程如下:
Ⅰ.污泥与普通黏土以一定比例混合(污泥占25%—30%)后制成砖坯,在窑中850—
Ⅱ.灼烧前期向窑中鼓入补充了氧气的空气。
Ⅲ.灼烧后期改用普通空气,且故意限制入窑空气的数量,使呈缺氧状态。烧制完成后,直到窑温降至
(2)前期鼓入富氧空气的原因是__________________________________________________。
(3)后期限制空气流入量的原因是_________________________________________________。
查看习题详情和答案>>
铁及铁的化合物在生产、生活中都有广泛应用.请回答下列问题:
(1)钢铁在空气中容易发生电化学腐蚀而生锈,请写出钢铁在空气中发生吸氧腐蚀时的正极反应方程式 .
(2)黄铁矿(FeS2)是工业生产硫酸的重要原料,其中所发生的一个反应为:3FeS2+8O2
6SO2+Fe3O4,则3molFeS2参加反应转移 mol电子.
(3)FeCl3溶液常用作印刷电路铜板腐蚀剂,该反应的离子方程式为 .
(4)治疗缺铁性贫血可用硫酸亚铁缓释片(Ferrous Sulfate Sustained Release Tablets),其主要成分是FeSO4?7H2O,其说明书上常写有“本品不应与浓茶同服”、“维生素C与本品同服,有利于本品吸收”等.维生素C对硫酸亚铁缓释片的主要作用是 .
某同学为测定某硫酸亚铁缓释片中FeSO4的含量进行了以下实验:
Ⅰ.取10片补血剂,称量,除去糖衣,研细,置于小烧杯中;
Ⅱ.加60mL稀硫酸与新沸过的冷水适量,振摇,使硫酸亚铁缓释片溶解;
Ⅲ.配制成250mL溶液,并从中准确量取20.00mL溶液,用一定物质的量浓度的酸性高锰酸钾溶液滴定.
①步骤Ⅱ中,稀硫酸的作用是 .
②配平下列化学方程式:
KMnO4+ FeSO4+ H2SO4= Fe2(SO4)3+ MnSO4+ K2SO4+ H2O
③该滴定实验中应选择 式滴定管,滴定达到终点时溶液的颜色是 色.
④若每消耗10mL酸性高锰酸钾溶液相当于含0.152g FeSO4,则该高锰酸钾溶液的物质的量浓度是 .
查看习题详情和答案>>
(1)钢铁在空气中容易发生电化学腐蚀而生锈,请写出钢铁在空气中发生吸氧腐蚀时的正极反应方程式
(2)黄铁矿(FeS2)是工业生产硫酸的重要原料,其中所发生的一个反应为:3FeS2+8O2
| ||
(3)FeCl3溶液常用作印刷电路铜板腐蚀剂,该反应的离子方程式为
(4)治疗缺铁性贫血可用硫酸亚铁缓释片(Ferrous Sulfate Sustained Release Tablets),其主要成分是FeSO4?7H2O,其说明书上常写有“本品不应与浓茶同服”、“维生素C与本品同服,有利于本品吸收”等.维生素C对硫酸亚铁缓释片的主要作用是
某同学为测定某硫酸亚铁缓释片中FeSO4的含量进行了以下实验:
Ⅰ.取10片补血剂,称量,除去糖衣,研细,置于小烧杯中;
Ⅱ.加60mL稀硫酸与新沸过的冷水适量,振摇,使硫酸亚铁缓释片溶解;
Ⅲ.配制成250mL溶液,并从中准确量取20.00mL溶液,用一定物质的量浓度的酸性高锰酸钾溶液滴定.
①步骤Ⅱ中,稀硫酸的作用是
②配平下列化学方程式:
③该滴定实验中应选择
④若每消耗10mL酸性高锰酸钾溶液相当于含0.152g FeSO4,则该高锰酸钾溶液的物质的量浓度是
(2011?太原二模)甲、乙两上实验小组分别进行测定Na2CO3和NaC1混合物中Na2CO3含量的实验.
甲组:沉淀分析法(相对分子质量:Na2CO3为106; BaCO3为197; BaCl2为208)
(1)配制一定物质的量浓度的BaC12溶液:用已经称量好的
(2)把m g混合物溶解后加入过量BaC12溶液,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为wg,根据沉淀质量计算原混合物中Na2CO3的质分数为
×100%
×100%(用含m、w的代数式表示).如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液中残留的CO32-的物质的量浓度是
乙组:气体分析法
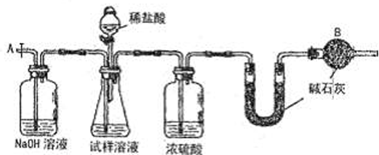
(3)实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是
(4)装置中干燥管B的作用是
(5)除已理的agNa2CO3样品外,实验中还应测定的数据是
(6)该实验还存在的明显缺陷是
查看习题详情和答案>>
甲组:沉淀分析法(相对分子质量:Na2CO3为106; BaCO3为197; BaCl2为208)
(1)配制一定物质的量浓度的BaC12溶液:用已经称量好的
20.8
20.8
gBaC12固体配制0.4mol?L-lBaCl2溶液250mL,所需要的仪器为量筒和烧杯、玻璃棒、250ml容量瓶、胶头滴管
烧杯、玻璃棒、250ml容量瓶、胶头滴管
.(2)把m g混合物溶解后加入过量BaC12溶液,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为wg,根据沉淀质量计算原混合物中Na2CO3的质分数为
| 106wg |
| 197mg |
| 106wg |
| 197mg |
2.58×10-7mol/L
2.58×10-7mol/L
.[Ksp(BaCO3)=2.58×10-9]乙组:气体分析法

(3)实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是
使产生的二氧化碳全部进入后续的装置
使产生的二氧化碳全部进入后续的装置
.(4)装置中干燥管B的作用是
吸收空气中的二氧化碳和水
吸收空气中的二氧化碳和水
.(5)除已理的agNa2CO3样品外,实验中还应测定的数据是
U型管
U型管
处(填图中仪器的名称)装置实验前后的质量差.(6)该实验还存在的明显缺陷是
盐酸具有挥发性,制得的二氧化碳中混有氯化氢,U型管增重的质量偏大,最后结果偏大.
盐酸具有挥发性,制得的二氧化碳中混有氯化氢,U型管增重的质量偏大,最后结果偏大.
.(1)根据物质的量浓度的概念,可以求出纯水的物质的量浓度是
(2)氧气在空气中的体积分数约为0.25,则标况下,空气中氧气的物质的量的浓度是
(3)将一定量的MgCl2 溶于90g 水中,是每100个水分子中就有1个Cl-,这一定量的MgCl2的物质的量为
查看习题详情和答案>>
55.5
55.5
mol?L-(2)氧气在空气中的体积分数约为0.25,则标况下,空气中氧气的物质的量的浓度是
0.011
0.011
mol?L-1.(3)将一定量的MgCl2 溶于90g 水中,是每100个水分子中就有1个Cl-,这一定量的MgCl2的物质的量为
0.025
0.025
.(一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:

(1)浓硫酸的作用是
(2)B中观察到的实验现象是
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是
(三)在标准状况下,35.5g氯气的体积是
查看习题详情和答案>>

(1)浓硫酸的作用是
除去氯气中的水蒸气
除去氯气中的水蒸气
.(2)B中观察到的实验现象是
不褪色
不褪色
.(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是
H+
H+
.上述溶液逐渐褪去,起作用的微粒是HClO
HClO
.加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是
Cl-
Cl-
.(三)在标准状况下,35.5g氯气的体积是
11.2
11.2
L,将其与氢气完全化合,需氢气的物质的量是0.5
0.5
mol,将生成的气体制成1L溶液,溶质的物质的量浓度是1
1
mol?L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是0.1
0.1
mol?L-1.