网址:http://m.1010jiajiao.com/timu3_id_434503[举报]
(1)新型离子化合物![]() 是一种功能材料.它可以用超酸
是一种功能材料.它可以用超酸![]() 和
和![]() 反应,使
反应,使![]() 得到质子来制取.该反应类型跟中学化学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)
得到质子来制取.该反应类型跟中学化学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)
_____________________________________________________________________
(2)离子型叠氮化物可以制成轿车的“安全气囊”.叠氮离子![]() 经由氨基钠(
经由氨基钠(![]() )与
)与![]() 在一定条件下合成.完成并配平反应的离子方程式
在一定条件下合成.完成并配平反应的离子方程式
________![]() +________
+________![]() ________
________![]() +________
+________![]() ________
________
(3)叠氮酸(![]() )分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
)分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
____________________________________________________________________
查看习题详情和答案>>
_____________________________________________________________________
(2)离子型叠氮化物可以制成轿车的“安全气囊”.叠氮离子![]() 经由氨基钠(
经由氨基钠(![]() )与
)与![]() 在一定条件下合成.完成并配平反应的离子方程式
在一定条件下合成.完成并配平反应的离子方程式
________![]() +________
+________![]() ________
________![]() +________
+________![]() ________
________
(3)叠氮酸(![]() )分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
)分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
____________________________________________________________________
查看习题详情和答案>>
(1)新型离子化合物[HC60]+[CB11H6Cl6]-是一种功能材料.它可以用超酸H(CB11H6Cl6)和C60反应,使C60得到质子来制取.该反应类型跟中学化学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)
________
(2)离子型叠氮化物可以制成轿车的“安全气囊”.叠氮离子 经由氨基钠(NaNH2)与
经由氨基钠(NaNH2)与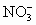 在一定条件下合成.完成并配平反应的离子方程式
在一定条件下合成.完成并配平反应的离子方程式
________ +________
+________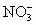 =________N+________NH3↑+________
=________N+________NH3↑+________
(3)叠氮酸(HN3)分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
________
查看习题详情和答案>>A.化合反应 B.复分解反应
C.氧化还原反应 D.置换反应
(2)离子型叠氮化物可以制成轿车的“安全气囊”,叠氮离子(![]() )可由氨基钠(NaNH2)与
)可由氨基钠(NaNH2)与![]() 在一定条件下合成,完成并配平反应的离子方程式:
在一定条件下合成,完成并配平反应的离子方程式:
□![]() +□
+□![]() ====□
====□![]() +□NH3↑+□□
+□NH3↑+□□
(3)叠氮酸(HN3)分子中共用电子对和未成键电子对的数目分别为6和2,据此写出叠氮酸分子可能的结构式_____________。
查看习题详情和答案>>氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4+ H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4+ 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
查看习题详情和答案>>