网址:http://m.1010jiajiao.com/timu3_id_434074[举报]
Ⅰ.电石
| 水 |
| 自然风干 |
①电石与水反应的化学方程式是
②残渣中主要成分是Ca(OH)2和
Ⅱ.将Ⅰ中的部分灰浆配成浊液,通入Cl2,得到Ca(ClO3)2与CaCl2物质的量之比为1:5的溶液,反应的化学方程式是
Ⅲ.向Ⅱ所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3 晶体.你认为能得到KClO3 晶体的原因是
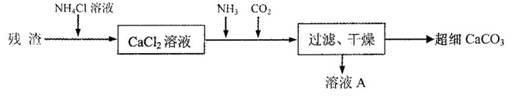
Ⅳ.将Ⅰ中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用.向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:

①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是
③图示的溶液A可循环使用,其主要成分的化学式是
(12 分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
查看习题详情和答案>>
(12分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
KClO3在农业上用作除草剂,超细CaCO3广泛用于消光纸、无炭复写纸等.某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
Ⅰ.![]()
①电石与水反应的化学方程式是________.
②残渣中主要成分是Ca(OH)2和________.
Ⅱ.将Ⅰ中的部分灰浆配成浊液,通入Cl2,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是________.
Ⅲ.向Ⅱ所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体.你认为能得到KClO3晶体的原因是________________.
Ⅳ.将Ⅰ中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用.向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
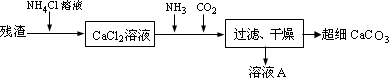
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________________.
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________.
③图示的溶液A可循环使用,其主要成分的化学式是________.
(12 分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
查看习题详情和答案>>
