网址:http://m.1010jiajiao.com/timu3_id_433797[举报]
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
(2)从母液中分离出H2O2和尿素,采用的操作是
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在
②完成并配平方程式:
③根据滴定结果,可确定产品中活性氧的质量分数为:
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知:?
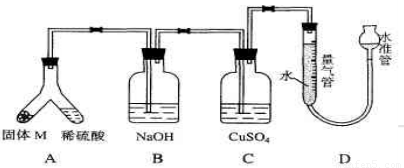
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。?
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。?
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________ 。?
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____ 。?
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫?
b.测定气体体积时水准管的水面高于量气管的水面?
c.A中留有反应生成的气体?
d.气体进入D装置前未用浓硫酸干燥
查看习题详情和答案>>
26.(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)

由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是_____________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
(B)
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。

③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看习题详情和答案>>过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是______.
(2)从母液中分离出H2O2和尿素,采用的操作是______.
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在______式(选填:“酸”、“碱”)滴定管中.
②完成并配平方程式:______MnO4-+______H2O2+______H+=______Mn2++______H2O+______
③根据滴定结果,可确定产品中活性氧的质量分数为:______.
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”).
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为______.
查看习题详情和答案>>
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:
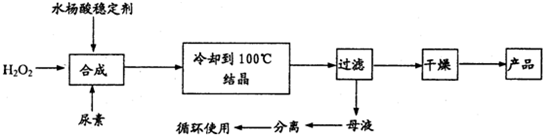
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是______.
(2)从母液中分离出H2O2和尿素,采用的操作是______.
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在______式(选填:“酸”、“碱”)滴定管中.
②完成并配平方程式:______MnO4-+______H2O2+______H+=______Mn2++______H2O+______
③根据滴定结果,可确定产品中活性氧的质量分数为:______.
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”).
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为______.