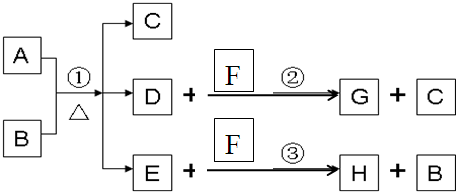
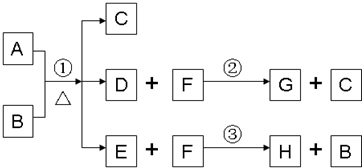
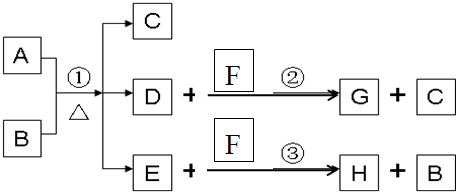
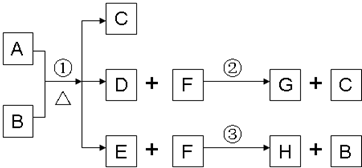
摘要: A为中学化学常见金属单质.将A投入足量B的浓溶液中.溶液总质量在反应前后保持不变.除A.C外其余各物质均含同一种元素X.F为X的氢化物.H为黑色沉淀 www.k@s@5@ 高#考#资#源#网 (1)纯净的B在固态时晶体类型为 .固态B熔化时克服的作用力类型是 .写出反应①的化学反应方程式 (2)G和过量NaOH溶液在加热时反应.氧化产物与还原产物的物质的量之比为1:2.写出该反应的化学方程式 (3)检验E中阴离子的操作方法为: (4)国内工业用含W的矿石制备B.该反应在 中进行.写出燃烧W的化学方程式.并标出电子转移的方向和数目.
网址:http://m.1010jiajiao.com/timu3_id_433169[举报]
A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,H为黑色沉淀
(1)纯净的B在固态时晶体类型为
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式
(3)检验E中阴离子的操作方法为:
(4)国内工业用含W的矿石制备B,该反应在
 .
.
查看习题详情和答案>>

(1)纯净的B在固态时晶体类型为
分子晶体
分子晶体
,固态B熔化时克服的作用力类型是分子间作用力
分子间作用力
,写出反应①的化学反应方程式Cu+2H2SO4
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4
CuSO4+SO2+2H2O
;
| ||
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式
3S+6NaOH
2Na2S+Na2SO3+3H2O
| ||
3S+6NaOH
2Na2S+Na2SO3+3H2O
;
| ||
(3)检验E中阴离子的操作方法为:
向硫酸铜溶液中加入硝酸酸化的氯化钡,如果出现白色沉淀,证明有硫酸根,反之,则没有
向硫酸铜溶液中加入硝酸酸化的氯化钡,如果出现白色沉淀,证明有硫酸根,反之,则没有
;(4)国内工业用含W的矿石制备B,该反应在
沸腾炉
沸腾炉
(填设备名称)中进行.写出燃烧W的化学方程式,并标出电子转移的方向和数目.

A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,G为淡黄色固体,H为黑色沉淀
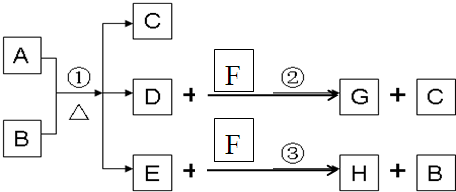
(1)写出下列物质的化学式
A
写出反应①的化学反应方程式
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的离子方程式
(3)检验E中阴离子的操作方法为:
查看习题详情和答案>>

(1)写出下列物质的化学式
A
Cu
Cu
DSO2
SO2
FH2S
H2S
GS
S
HCuS
CuS
,写出反应①的化学反应方程式
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的离子方程式
3S+6OH-=2S2-+SO32-+3H2O
3S+6OH-=2S2-+SO32-+3H2O
(3)检验E中阴离子的操作方法为:
取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在
取少量E溶液,先加入稀盐酸,再加入BaCl2溶液,若产生白色沉淀,则证明有SO42-存在
.