摘要:在恒温恒容的密闭容器中.通入x mol N2和y mol H2发生如下反应:N2 + 3H2 2NH3,.平衡后.测得反应放出的热量为18.4 kJ.混合气体总的物质的量为3.6 mol.容器内的压强变为原来的90%.又知N2和H2的转化率相同. (1)通过计算说明起始充入N2和H2的物质的量分别为:x = .y = .平衡后NH3的体积分数 (2)写出该反应的热化学方程式 . (3)如果把上述反应在恒温恒压的条件下反应放出的热量应该 18.4 kJ. (3)若起始加入N2.H2和NH3的物质的量分别为a mol.b mol.c mol.达平衡时各物质的含量与上述平衡完全相同. ①若c = 2.在相同的条件下达平衡时.该反应吸收的热量为 kJ. ②若维持反应向正反应方向进行.则起始时c的取值范围为 .
网址:http://m.1010jiajiao.com/timu3_id_433071[举报]
在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2+3H2 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
(1)通过计算说明起始充入N2和H2的物质的量分别为:x=
(2)写出该反应的热化学方程式
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该
(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为
②若维持反应向正反应方向进行,则起始时c的取值范围为
查看习题详情和答案>>
 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.(1)通过计算说明起始充入N2和H2的物质的量分别为:x=
1
1
,y=3
3
.平衡后NH3的体积分数| 1 |
| 9 |
| 1 |
| 9 |
(2)写出该反应的热化学方程式
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
.(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该
大于
大于
18.4kJ(填大于、小于或等于).(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为
73.6
73.6
kJ.②若维持反应向正反应方向进行,则起始时c的取值范围为
0≤c<0.4
0≤c<0.4
.(8分)在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生反应N2 + 3H2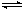 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x = ,y =  。
。
⑵若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上 述平衡完全相同。
述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为 。
(8分)在恒温恒容的密闭容器中,通入x
mol N2和y mol H2发生反应N2 + 3H2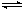 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴ 通过计算说明起始充入N2和H2的物质的量分别为:x = ,y = 。
⑵ 若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同。
① 若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
② 若维持反应向正反应方向进行,则起始时c的取值范围为 。
查看习题详情和答案>>
在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2+3H2 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
(1)通过计算说明起始充入N2和H2的物质的量分别为:x=______,y=______.平衡后NH3的体积分数______
(2)写出该反应的热化学方程式______.
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该______18.4kJ(填大于、小于或等于).
(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为______kJ.
②若维持反应向正反应方向进行,则起始时c的取值范围为______.
查看习题详情和答案>>
 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.(1)通过计算说明起始充入N2和H2的物质的量分别为:x=______,y=______.平衡后NH3的体积分数______
(2)写出该反应的热化学方程式______.
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该______18.4kJ(填大于、小于或等于).
(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为______kJ.
②若维持反应向正反应方向进行,则起始时c的取值范围为______.
查看习题详情和答案>>