摘要: Al..均既能与盐酸反应又能与氢氧化钠反应.都属于两性化合物
网址:http://m.1010jiajiao.com/timu3_id_431801[举报]
已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态.G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液.A在常温下为气态,与氧气完全反应时的体积比是1:2.W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1.各物质有如图所示的转化关系(部分反应的产物未全部表示).试回答下列问题:
(1)B的电子式为
 ,固体乙的化学式可能是
,固体乙的化学式可能是
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号)
(3)写出W和水反应的化学方程式
查看习题详情和答案>>

(1)B的电子式为


Fe2O3
Fe2O3
;(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号)
①③④
①③④
;(3)写出W和水反应的化学方程式
Al(CH3)3+3H2O=3CH4↑+Al(OH)3 ↓
Al(CH3)3+3H2O=3CH4↑+Al(OH)3 ↓
,I和NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.下列关于“两性化合物”的叙述中,正确的是
- A.H2S与HNO3、NaOH溶液分别反应时,均可生成水,所以H2S是两性化合物
- B.碳酸钠既能与盐酸,又能与氢氧化钡溶液反应,所以碳酸钠是两性化合物
- C.铝既能与稀硝酸反应,又能与氢氧化钠溶液反应,所以铝是两性化合物
- D.Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,所以Al(OH)3是两性化合物
(2011?湖南模拟)A、B、C、D、E是原子序数递增的五种短周期元素,其中A元素组成的一种粒于不含电子;B元素的最高价氧化物的水化物甲能与其氢化物生成一种盐乙;D的单质能与酸、碱反应均生成氢气;A、B、D三种元素都能与C元素形成常见化舍物;D、E两种元素组成DE3型化合物,
(1)写出由以上某些元素构成的既含极性共价键,又含非极性共价键的化台物的电子式: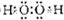
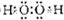 (写出一种即可)
(写出一种即可)
(2)B的常见氢化物的空间构型是
(3)常温下1克A单质在足量C单质中燃烧生成稳定的液态物质释放出142.9kJ热量,写出表示A单质燃烧热的热化学方程式:
(4)A单质和C单质在浓KOH溶液做电解质溶液时可形成原电池,写出该电池中正极的电极反应方程式:
(5)常温下,甲、乙的水溶液的pH均为5.则两溶液中由水电离出的H+浓度之比是
(6)由上述元素所形成的常见物质X、Y、Z、W、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为
②M→N的化学反应方程式为
查看习题详情和答案>>
(1)写出由以上某些元素构成的既含极性共价键,又含非极性共价键的化台物的电子式:
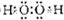
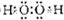
(2)B的常见氢化物的空间构型是
三角锥形
三角锥形
.(3)常温下1克A单质在足量C单质中燃烧生成稳定的液态物质释放出142.9kJ热量,写出表示A单质燃烧热的热化学方程式:
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
;| 1 |
| 2 |
(4)A单质和C单质在浓KOH溶液做电解质溶液时可形成原电池,写出该电池中正极的电极反应方程式:
O2+2H2O+4e-=40H-
O2+2H2O+4e-=40H-
;(5)常温下,甲、乙的水溶液的pH均为5.则两溶液中由水电离出的H+浓度之比是
10-4:1
10-4:1
;(6)由上述元素所形成的常见物质X、Y、Z、W、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;②M→N的化学反应方程式为
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
.
| ||