网址:http://m.1010jiajiao.com/timu3_id_431718[举报]
(11分) 右图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2  2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
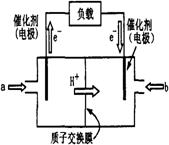
(1)该装置中 (填a或b)为电池的负极,其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g)  2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=
; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将
(填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将
(填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=
; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将
(填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将
(填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g)ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
查看习题详情和答案>>
(11分) 右图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2 ![]() 2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
(1)该装置中 (填a或b)为电池的负极,其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g) ![]() 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g)ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
查看习题详情和答案>>
(11分)右图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2 2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
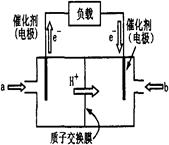
(1)该装置中 (填a或b)为电池的负极,其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g)  2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g)ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH= +b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
 2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
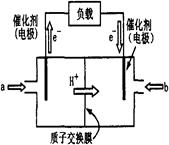
(1)该装置中 (填a或b)为电池的负极,其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g)
 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。(3)又已知在该条件下H2O(l)=H2O(g)ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=
 +b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
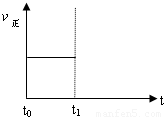
(3)上述反应在t时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
 查看习题详情和答案>>
查看习题详情和答案>>