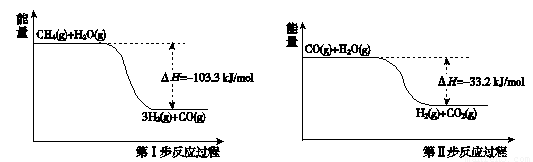
摘要:19.氢气是一种清洁能源.用甲烷制取氢气的两步反应的能量变化如下图所示: (1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 . (2)第II步为可逆反应.在800℃时.若CO的起始浓度为2.0 mol/L.水蒸气的起始 浓度为3.0 mol/L.达到化学平衡状态后.测得CO2的浓度为1.2 mol/L.则此反 应的平衡常数为 .CO的平衡转化率为 .
网址:http://m.1010jiajiao.com/timu3_id_431379[举报]
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
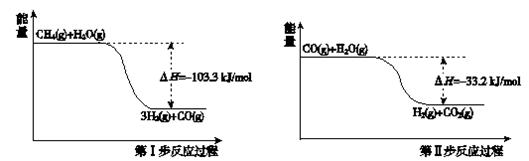
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,CO的平衡转化率为 。
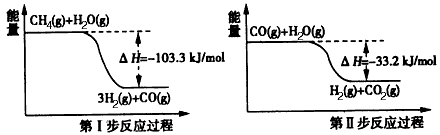
查看习题详情和答案>>氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,CO的平衡转化率为 。
查看习题详情和答案>>
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示: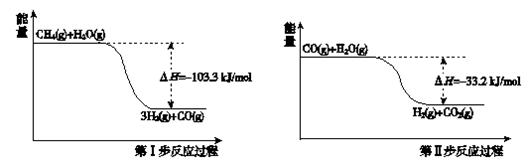
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,CO的平衡转化率为 。