摘要:25.00 mL溶液.用0.1 mol·L-1的NaOH溶液滴定.用酚酞作指示剂.滴定前后的滴定管中液面的位置如图所示. 在B容器中生成硝酸的物质的量为 . (2)测定NO的体积 ①从上图所示的装置中.你认为应选用 装置进行Ag与浓硝酸反应实验.选用的理由是 . ②选用如上图所示仪器组合一套可用来测定生成NO体积的装置.其合理的连接顺序 是 . ③在测定NO的体积时.若量筒中水的液面比集气瓶的液面要低.此时应将量筒的位置 .以保证量筒中的液面与集气瓶中的液面持平. (3)气体成份分析 ①若实验测得NO的体积为93.0 mL.则Ag与浓硝酸反应过程中 NO产生.作此判断的依据是 . ②本题中.浓硝酸完全反应.还原产物只有NO和NO2.被还原硝酸的物质的量n的取值范围为 .
网址:http://m.1010jiajiao.com/timu3_id_429774[举报]
常温下,用 0.01 mol·L-1 NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
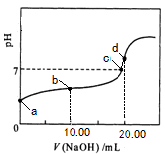
A.a点对应溶液的pH=2
B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+)
C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应
D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看习题详情和答案>>
常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是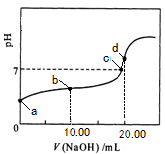
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 00 mol·L-1 CH3COOH溶液滴定曲线如图所示。下列说法正确的是

A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看习题详情和答案>>