网址:http://m.1010jiajiao.com/timu3_id_428863[举报]
 A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).请回答下列问题:
(1)D的化学式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
(4)0.1mol?L-1的X溶液和0.1mol?L-1的Y溶液等体积混合,溶液呈
(5)常温下0.1mol?L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol?L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol?L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9.

请回答下列问题:
(1)D的化学式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
(4)0.1mol?L-1的X溶液和0.1mol?L-1的Y溶液等体积混合,溶液呈
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).请回答下列问题:
(1)D的化学式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
| ||
| △ |
| ||
| △ |
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
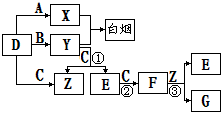
请回答下列问题:
⑴D的化学式为 。
⑵反应③的离子方程式为 。
⑶Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
⑷0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈________性(填“酸”、“碱”或“中”),原因是_______________________________________(用离子方程式说明)。
⑸常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
查看习题详情和答案>>A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为
红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
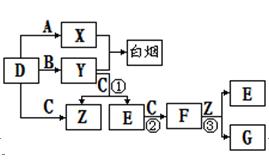
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)原因是: __________________________________
(用离子方程式说明)
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
查看习题详情和答案>>