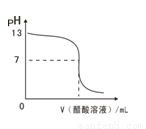
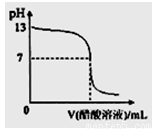
摘要:11.常温下.向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液.所得滴定曲线如下图所示.下列说法正确的是 ( ) A.pH=7时.所加醋酸溶液的体积为10mL B.pH<7时.溶液中:c(CH3COO-)>c(Na+) C.7<pH<13时.溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.继续滴加0.1 mol·L-1醋酸溶液.溶液pH可以变为1 [答案]B [解析]当NaOH溶液和醋酸恰好完全反应时.生成醋酸钠水解而使溶液显碱性.故A错.当pH<7时有c(H+)>c(OH-).根据电荷守恒可得c(CH3COO-)>c(Na+).故B正确.当7<pH<13时.溶液也有c(Na+)> c(OH-)> c(CH3COO-)>c(H+)这一种情况.C错.对于选项D可作一极端设想.若溶液就是0.1 mol·L-1醋酸.由于醋酸是弱酸.溶液的pH也大于1.故D也错. [考点]电解质溶液--离子浓度的大小比较
网址:http://m.1010jiajiao.com/timu3_id_428860[举报]
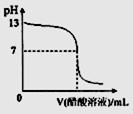 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
查看习题详情和答案>>常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )

A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
查看习题详情和答案>>常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
查看习题详情和答案>>