网址:http://m.1010jiajiao.com/timu3_id_427960[举报]
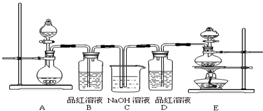
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
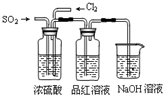
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的
②试分析甲同学实验过程中,品红溶液不褪色的原因是:
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
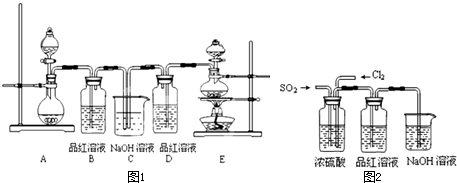
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?

(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质_______________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B______________,D______________。
(3)装置C的作用是____________________________。
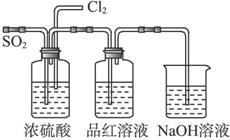
(4)该实验小组的甲、乙两位同学利用上述两发生装置按上图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的目的:。
②试分析甲同学实验过程中,品红溶液不褪色的原因是___________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?____________________________。
查看习题详情和答案>>某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
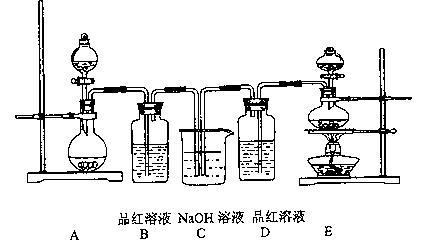
(1)实验室常用装置E制各Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
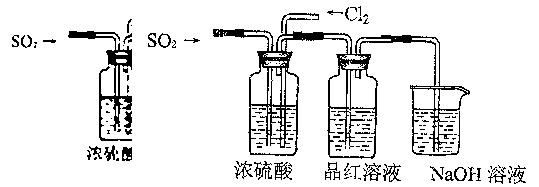
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是
品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(文字结合离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的? 。
查看习题详情和答案>>某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制各Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是
品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(文字结合离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的? 。
查看习题详情和答案>>