摘要:2004年7月德俄两国化学家共同宣布.在高压下氮气会聚合生成高聚氮.这种高聚氮的 晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160 kJ·mol-1.而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量).则下列有关说法不正确的是 A.键能越大说明化学键越牢固.所构成物质越稳定 B.高聚氮晶体属于原子晶体 C.高聚氮晶体中n(N)∶n(N-N)=1∶3 D.用作炸药或高能材料可能是高聚氮潜在的应用 5.下列各组离子能在指定环境中大量共存的是 A.在c(HCO3-)=0.1mol/L的溶液中:NH4+.Al3+.Cl-.NO3- B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+.ClO-.Na+.SO42- C.pH=1的溶液中:Mg2+.Fe3+.NO3-.[Ag(NH3)2]+ D.在使红色石蕊试纸变蓝的溶液中:SO32-.CO32-.Na+.K+ 6.某一胶体进行电泳实验时.胶体微粒向阴极移动.对胶体进行下列操作时.能使胶体发生凝聚的是①加入酒精,②加入MgSO4溶液,③加入Fe(OH)3溶胶,④加入H2SiO3溶胶,⑤降低温度 A.②③ B.②④ C.①③ D.①⑤ 7.高铁酸钾(K2FeO4)是一种新型.高效.多功能水处理剂.是比Cl2.O3.ClO2.KMnO4氧化性更强.无二次污染的绿色处理剂.工业是先制得高铁酸钠.然后在低温下.在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).湿法制备的主要反应方程为: 2Fe(OH)3+3ClO-+4OH--→2FeO42-+3Cl-+5H2O 干法制备的主要反应为:2FeSO4+6Na2O2-→2Na2FeO4+2Na2O+2Na2SO4+O2↑ 下列有关说法不正确的是 A.高铁酸钾中铁显+6价 B.湿法中每生成1 mol Na2FeO4转移3 mol电子 C.干法中每生成1 mol Na2FeO4转移4 mol电子 D.K2FeO4处理水时.不仅能消毒杀菌.还能除去水体中的H2S.NH3等.生成的Fe(OH)3还能吸附水中的悬浮杂质 8.从下列事实所列出的相应结论正确的是 实 验 事 实 结 论 ① Cl2的水溶液可以导电 Cl2是电解质 ② 将燃烧的镁条放入CO2中能继续燃烧 还原性:Mg>C ③ NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 酸性:HCO3->Al(OH)3 ④ 常温下白磷可自燃而氮气须在放电时才与氧气反应 非金属性:P>N ⑤ 某无色溶液中加入氢氧化钠溶液并加热.产生的气体能使湿润红色石蕊试纸变蓝 该溶液一定有NH4+ A.③④⑤ B.②③⑤ C.①②③ D.全部 9.下列离子方程式正确的是 A.溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2-→2Fe3++2Br2+6Cl- B.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++Cl2↑+2Cl-+2H2O C.用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq) -→ CuS(s)↓ D.1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4-→Na2SO4(aq)+2H2O(1)+57.3 kJ·mol-1 10.A和B两元素分别得到两个电子后.都变成零族元素的电子层结构.其中A放出的能量比B大.因此 A.A比B容易被还原 B.A2-的还原性比B2-的强 C.A的氧化性比B弱 D.A2-比B2-的半径大
网址:http://m.1010jiajiao.com/timu3_id_427603[举报]
2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.则下列有关说法不正确的是( )
查看习题详情和答案>>
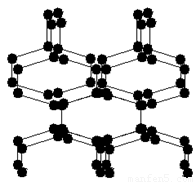
 2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol (N2的键能为942kJ/mol),晶体结构如图所示.这种晶体属于
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol (N2的键能为942kJ/mol),晶体结构如图所示.这种晶体属于原子
原子
晶体.这种固体的可能潜在应用是炸药(或高能材料)
炸药(或高能材料)
,这是因为:高聚氮分解成N2释放大量能量
高聚氮分解成N2释放大量能量
.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160kJ?mol-1,而N≡N的键能为942kJ?mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量).则下列有关说法不正确的是( )
| A、键能越大说明化学键越牢固,所构成物质越稳定 | B、高聚氮晶体属于原子晶体 | C、高聚氮晶体中n(N):n(N-N)=1:3 | D、用作炸药或高能材料可能是高聚氮潜在的应用 |