摘要:25.1100℃时.在恒容密闭容器中.发生可逆反应: Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g) 并达到平衡.请完成下列各题: (1)达到平衡时的平衡常数表达式K= . 降低温度.K值减小.则正反应为 反应. (2)向该容器中分别加入以下物质.对平衡的影响如何?(填“正向移动 .“逆向移动 或“不发生移动 ) ①加入少量Na2SO4.则平衡: ②通入少量H2S气体.则平衡: (3)若初始时加入的Na2SO4为2.84g.达平衡时Na2SO4的转化率为45%.则达平衡时该容器内固体的总质量是 . (4)若将平衡体系温度降低100℃.下述图象中能正确反映平衡移动过程中容器内变化情况的是 .
网址:http://m.1010jiajiao.com/timu3_id_425420[举报]
| |||||||||||||||||||||||||||||
I.1100℃时,在恒容密闭容器中,发生如下可逆反应: Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
(1)达到平衡时的平衡常数表达式:K=________;降低温度,K值减小,则正反应为_________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
①加入少量Na2SO4,则平衡____________(填所选字母,下同);
②加入少量灼热的Fe3O4,则平衡_____________。
a.正向移动 b.逆向移动 c.不发生移动
Ⅱ.将CH4设计成燃料电池,其利用率更高,装置示意如图 (A、B为多孔性碳棒),持续通入甲烷,在标准状况下,消耗甲烷体积VL。
 Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
Na2S(s)+4H2O(g),并达到平衡。请完成下列各题: (1)达到平衡时的平衡常数表达式:K=________;降低温度,K值减小,则正反应为_________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
①加入少量Na2SO4,则平衡____________(填所选字母,下同);
②加入少量灼热的Fe3O4,则平衡_____________。
a.正向移动 b.逆向移动 c.不发生移动
Ⅱ.将CH4设计成燃料电池,其利用率更高,装置示意如图 (A、B为多孔性碳棒),持续通入甲烷,在标准状况下,消耗甲烷体积VL。
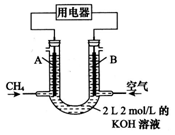
(1)0<V≤44.8 L时,电池总反应方程式为_____________;
(2)44.8 L<V≤89.6 L时,负极的电极反应式为__________;
(3)V =67.2 L时,溶液中阴离子浓度大小关系为________________
查看习题详情和答案>>
(2)44.8 L<V≤89.6 L时,负极的电极反应式为__________;
(3)V =67.2 L时,溶液中阴离子浓度大小关系为________________
 Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)


