摘要:13.火法炼铜过程中发生下列反应:3Cu2S+2O2 6Cu+3SO2.下列说法不军确的是( ) A.Cu2S只做还原剂 B.氧化剂与还原剂的物质的量之比为2:1 C.1 mol Cu2S和O2反应生成2 molCu.转移电子的物质的量为6mol D.反应消耗3 mol Cu2S时.被O2氧化的硫(S)的物质的量为2 mol 14.右图为元素周期表中短周期的一部分.关于推断Y.Z.M的说法正确的是 ( ) A.非金属性:Y>Z>M B.离子半径:M- >Z2->Y- C.ZM:分子中各原子的最外层均满足8电子稳定结构 D.三种元素中.Y的最高价氧化物对应的水化物酸性最强
网址:http://m.1010jiajiao.com/timu3_id_423692[举报]
火法炼铜过程中发生下列反应:3Cu2S+3O2
6Cu+3SO2.下列说法不正确的是( )
| ||
| A、Cu2S只做还原剂 |
| B、氧化剂与还原剂的物质的量之比为2:1 |
| C、1 mol Cu2S和O2反应生成2 molCu,转移电子的物质的量为6mol |
| D、反应消耗3 mol Cu2S时,被O2氧化的硫(S)的物质的量为2 mol |
火法炼铜过程中发生下列反应:3Cu2S+3O2=6Cu +3SO2, 下列说法不正确的是
[ ]
A.Cu2S只做还原剂
B.氧化剂和还原剂的物质的量之比为2:1
C.1 mol Cu2S和O2反应生成2 mol Cu转移的电子数为6mol
D.反应消耗3 mol Cu2S时,被O2氧化的硫(s)的物质的量为2 mol
查看习题详情和答案>>
B.氧化剂和还原剂的物质的量之比为2:1
C.1 mol Cu2S和O2反应生成2 mol Cu转移的电子数为6mol
D.反应消耗3 mol Cu2S时,被O2氧化的硫(s)的物质的量为2 mol
活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用.但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义.如图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:

含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3.
(1)操作a名称是
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:①将Fe3+还原为Fe2+;②
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是
(4)表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为10mol-l计算).反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方程式:
(5)操作b的名称是
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3?bZn(OH)2?cH2O(a、b、c均为整数).某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为
查看习题详情和答案>>

含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3.
(1)操作a名称是
过滤
过滤
,在实验室中,该过程用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.(2)溶解池中待固体全部溶解后,加入锌粉的作用有:①将Fe3+还原为Fe2+;②
除去杂质Cu2+
除去杂质Cu2+
:③调节溶液的pH(控制其在5.0-5.4之间).(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是
KSCN溶液
KSCN溶液
;(4)表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为10mol-l计算).反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方程式:
2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+
2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+
.| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
;(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3?bZn(OH)2?cH2O(a、b、c均为整数).某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为
ZnCO3?2Zn(OH)2?2H2O
ZnCO3?2Zn(OH)2?2H2O
.(2010?朝阳区一模)铜及其化合物在生产、生活中有广泛的应用.
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被
(2)印刷电路板上使用的铜需要回收利用.
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:
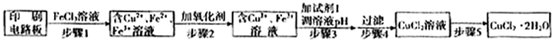
①证明步骤Ⅰ所加FeCl3溶液过量的方法是
②步骤2中所加的氧化剂最适宜的是
A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
O2(g)═H2O(l)△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=
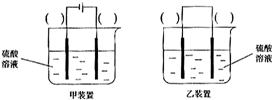
(3)欲实现反应Cu+H2SO2═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
查看习题详情和答案>>
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
| ||
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被
还原
还原
(填“氧化”或“还原”)成铜单质.(2)印刷电路板上使用的铜需要回收利用.
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:
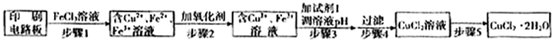
①证明步骤Ⅰ所加FeCl3溶液过量的方法是
取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
.②步骤2中所加的氧化剂最适宜的是
B
B
.A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是
CuO或Cu(OH)2
CuO或Cu(OH)2
.(写出一种即可)④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是
CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2?2H2O.方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
| 1 |
| 2 |
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=
+64kJ/mol
+64kJ/mol
.(3)欲实现反应Cu+H2SO2═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
