网址:http://m.1010jiajiao.com/timu3_id_423384[举报]
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
| 15 | 16 |
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是
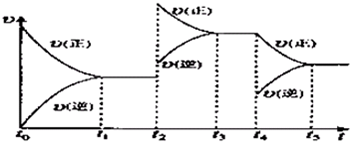
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
Na2CO3+NO+NO2→2NaNO2+CO2,Na2CO3+2NO2→NaNO3+NaNO2+CO2.
(1)根据废气排放标准,1m3烟气最高允许含400mg NOx.若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO
(2)若NOx通入NaOH溶液被完全吸收时,x的值不可能为
A.1.3 B.1.5 C.1.6 D.1.9
加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O.当烟气中n(NO):n(NO2)=2:3
时,吸收率最高.1m3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1.
(3)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数).
(4)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速.计算结果保留1位小数).

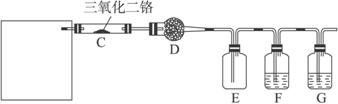
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热__________装置,原因是_______________;
(2)D装置中应填充的物质是__________,该物质的主要作用是______________________;
(3)E装置的作用是__________,F、G装置中的物质分别是_____________,__________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。
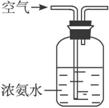
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是______________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是__________________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是____________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。

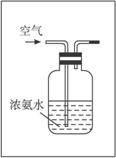
回答下列问题:
(1)写出A中反应的化学方程式_________________,实验时,A、C两装置均需加热,应先加热_________________装置,原因是__________________________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是________________________。
(3)E装置的作用是_________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。
