摘要:满分值:100分.考试时间:90分钟.
网址:http://m.1010jiajiao.com/timu3_id_420688[举报]
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀.[已知:CuCO3和Cu(OH)2均不带结晶水]
(Ⅰ)按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
(Ⅱ)请用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(1)各装置连接顺序为
(2)装置C中装有试剂的名称是
(3)能证明生成物中有CuCO3的实验现象是
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过图2所示装置的连接,进行定量分析来测定其组成.
(1)各装置连接顺序如为C→A→B→D→E,实验开始时和实验结束时都要通入过量的空气其作用分别是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:
查看习题详情和答案>>
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀.[已知:CuCO3和Cu(OH)2均不带结晶水]
(Ⅰ)按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
Na2CO3+CuSO4+H2O=Cu(OH)2↓+Na2SO4+CO2↑
Na2CO3+CuSO4+H2O=Cu(OH)2↓+Na2SO4+CO2↑
;在探究沉淀物成分前,须将沉淀从溶液中分离并净化.具体操作为①过滤②洗涤③干燥.(Ⅱ)请用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(1)各装置连接顺序为
A
A
→C
C
→B
B
.(2)装置C中装有试剂的名称是
无水硫酸铜
无水硫酸铜
.(3)能证明生成物中有CuCO3的实验现象是
装置B中澄清石灰水变浑浊
装置B中澄清石灰水变浑浊
.
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过图2所示装置的连接,进行定量分析来测定其组成.
(1)各装置连接顺序如为C→A→B→D→E,实验开始时和实验结束时都要通入过量的空气其作用分别是
开始时通入处理过的空气可以将装置中原有含水蒸气和CO2的空气排出;结束时通入处理过的空气可以将装置中滞留的水蒸气和CO2排出
开始时通入处理过的空气可以将装置中原有含水蒸气和CO2的空气排出;结束时通入处理过的空气可以将装置中滞留的水蒸气和CO2排出
.(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:
(1-
)×100%
| 49n |
| 9m |
(1-
)×100%
.| 49n |
| 9m |
(8分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| l | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(2)列式并计算该反应在O-5min时间内产物Z的平均反应速率: ;
(3)该反应在第 分钟(min)时达到平衡状态;
(4)若使该反应的速率增加,下列措施一定不能达到目的的是 。
A.升高温度
B.降低温度
C.使用催化剂
D.保持容器体积不变加入lmolx和2moly 查看习题详情和答案>>
(9分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:___________________;
(4)该反应达到平衡时反应物X的转化率α等于 ;
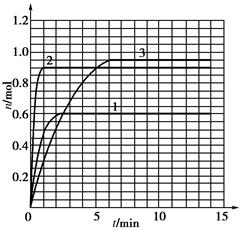
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。
 查看习题详情和答案>>
查看习题详情和答案>>
(14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
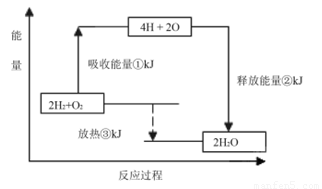
① kJ ② kJ ③ kJ
查看习题详情和答案>>