网址:http://m.1010jiajiao.com/timu3_id_420487[举报]

 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:(1)操作①的名称是:
操作④需要的玻璃仪器有:
(2)
(3)同学甲提出一些新的方案,对上述操作②后
无色溶液进行除杂提纯,其方案如下:
(有关资料)
| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |

(i)若在操作⑤结束后发现溶液B略有浑浊,应采取的措施是
(ii)写出混合液a加入到无色溶液中发生的离子反应方程式:
(检验除杂效果)
(ⅲ)为检验Mg2+、SO42-是否除尽,通常分别取悬浊液A上层清液于两试管中.进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中最好加入某溶液X,如果没有沉淀生成,表明Mg2+已除尽.
步骤二:检验SO42-是否除尽.向另一支试管中加入某溶液Y,如果没有沉淀生成,则SO42-已除尽.则溶液X、Y分别是
A、K2CO3、BaCl2 B、KOH、BaCl2 C、Ba(OH)2、CaCl2
(获取纯净氯化钾)
(ⅳ)对溶液B加热并不断滴加l mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.
(ⅴ)将溶液C倒入
(问题讨论)
(ⅵ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度

请根据以上流程,回答相关问题:

(1)操作①的名称是:
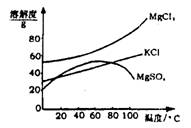
(2)参照右图溶解度曲线,固体B的主要成分
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
(有关资料)
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

(i)若在操作⑤结束后发现溶液B略有浑浊,应采取的措施是
(ii)混合液A的主要成分是
(检验除杂效果)
(ⅲ)为检验Mg2+、SO42-是否除尽,通常分别取悬浊液A上层清液于两试管中.进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中加入某溶液,如果没有沉淀生成,则表明Mg2+已除尽.效果最好的是
A.K2 CO3 B.KOH C.CaCl2
步骤二:检验SO42-是否除尽.向另一支试管中加入BaCl2溶液,如果无有沉淀生成,则SO42-已除尽.
(获取纯净氯化钾)
(ⅳ)对溶液B加热并不断滴加l mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.
(ⅴ)将溶液C倒入
(问题讨论)
(ⅵ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度

请根据以上流程,回答相关问题:
(1)操作①是
(2)参照如图2所示溶解度曲线,欲得到较纯净的氯化钾晶体需用少量的
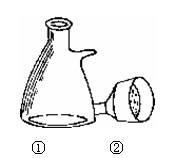
(3)在实验室常用减压的方法进行过滤,俗称抽滤,试猜想这种过滤方法的优点是
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
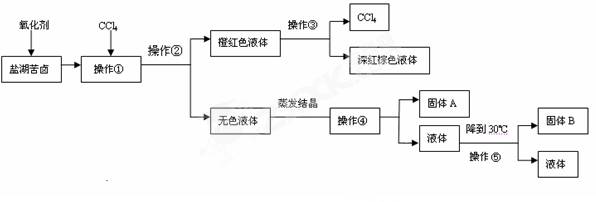
请根据以上流程,回答相关问题:
(1)操作①的名称__________;操作②名称是_________。
(2)参照右图溶解度曲线,固体A是 (写化学式);固体B是 (写化学式);欲得到较纯的固体B需用少量的_______________(选填:“热水”,“冷水”)洗涤固体。
(3)操作⑤是实验室常用的过滤方法——减压过滤(俗称抽滤)。请写出右图中减压过滤常用的两种仪器名称:① ;
② ;请问这种过滤方法其优点是
。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是
(2)参照下图溶解度曲线,得到的固体A的主要成分是 (填化学式)。
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
【设计除杂过程】
a、已知试剂B是K2CO3溶液,则溶液A的主要成分是 (填化学式)。
【获取纯净氯化钾】
b、对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体时,停止加热。
【问题讨论】
c、进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
查看习题详情和答案>>