摘要:(1) H202的水洛液为二元弱酸.科学家对H202结构的认识经历了较为漫长的过程.最初他们提出了两种 观点: a. (式中0→0表示共用电子对由前一个氧原子提供〉和b. ①请用电子式表示b的结构 ②写出H202在水溶液中的电离方程式 (2)①用单质碘和氯酸钾可以制得碘酸钾.其中涉及的一个反应为: I2+KCl03+H2O→KH(IO3)2+KCl+Cl2↑.因此有人认为I2的氧化性强于氯气.你 (填 "同意"或"不同意..)该观点.理由是 ②用电化学方法也可以制碘酸钾.原理是以石墨为阳极.不锈钢为阴极.以碘化钾榕液为电解质溶液.在一定电流和温度下进行电解〈同时不断搅拌电解质溶液〉其电解总反应式为: KI+3H20 KI03+3H2↑ 出阳极的电极反应式
网址:http://m.1010jiajiao.com/timu3_id_420048[举报]
(2013?杭州一模)Na2S2O3?5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20℃和70℃时的溶解度分别为60.0g 和212g,Na2S2O3?5H2O于40~45℃熔化,48℃分解.下面是实验室制备及相关性质实脸.
制备海波的反应原理:Na2SO3+S
Na2S2O3制备海波的流程:

(1)实验开始时用lmL乙醇润湿硫粉的作用是.
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是
(3)滤液不采用直接蒸发发结晶的可能原因是
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水洛液滴定,重复三次,平高均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3═2NaI+Na2S4O6产品的中Na2S2O3?5H2O的纯度为
查看习题详情和答案>>
制备海波的反应原理:Na2SO3+S
| ||

(1)实验开始时用lmL乙醇润湿硫粉的作用是.
A
A
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是
防止温度降低而使Na2S2O3晶体析出
防止温度降低而使Na2S2O3晶体析出
.(3)滤液不采用直接蒸发发结晶的可能原因是
直接蒸发结晶易使Na2S2O3?5H2O熔化、分解
直接蒸发结晶易使Na2S2O3?5H2O熔化、分解
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是
A
A
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水洛液滴定,重复三次,平高均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3═2NaI+Na2S4O6产品的中Na2S2O3?5H2O的纯度为
99.2
99.2
%Na2S2O3?5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20℃和70℃时的溶解度分别为60.0g 和212g,Na2S2O3?5H2O于40~45℃熔化,48℃分解.下面是实验室制备及相关性质实脸.
制备海波的反应原理:Na2SO3+S  Na2S2O3制备海波的流程:
Na2S2O3制备海波的流程:
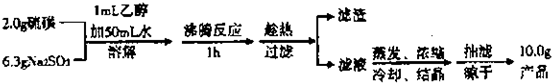
(1)实验开始时用lmL乙醇润湿硫粉的作用是.______
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是______.
(3)滤液不采用直接蒸发发结晶的可能原因是______
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是______
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水洛液滴定,重复三次,平高均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3═2NaI+Na2S4O6产品的中Na2S2O3?5H2O的纯度为______%
查看习题详情和答案>>
 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
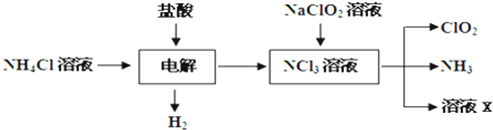
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
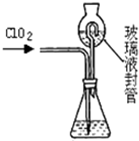
(3)测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③测得ClO2的质量m(ClO2)=
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.

①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
②装置中玻璃液封管的作用是
③滴定至终点的现象是
④测得ClO2的质量m(ClO2)
(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
查看习题详情和答案>>

(1)写出电解时发生反应的化学方程式:
NH4Cl+2HCl═3H2↑+NCl3
NH4Cl+2HCl═3H2↑+NCl3
.(2)除去ClO2中的NH3可选用的试剂是
C
C
.(填序号)A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.

①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
.②装置中玻璃液封管的作用是
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
.③滴定至终点的现象是
溶液由蓝色恰好变为无色,且半分钟内不褪色
溶液由蓝色恰好变为无色,且半分钟内不褪色
.④测得ClO2的质量m(ClO2)
1.35cv×10-2g
1.35cv×10-2g
.(用含c、V的代数式表示)(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |
(2007?资阳二模)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:C+K2CrO7+H2SO4--CO2↑+K2SO4+Cr2(SO4)3+H2O
(1)H2SO4 在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(2)若 12g 储氢纳米碳管含碳纳米颗粒的质量分数为 30%,除去这些杂质需要0.1mol/L的K2Cr2O7 洛液
(3)在常温下,该反应所需的硫酸溶液 pH=a,它与 pH=b 的 NaOH 溶液按体积比 1:100 混合刚好成中性,则 a 与 b 的关系式为:
(4)合成储氢纳米碳管的碳主要由甲烷热分解获得,川东地区新近发现一大型天然气田,为合成储氢纳米碳管工业生产提供了丰富的原料,同时天然气又是一种重要的能源,1g 甲烷燃烧生成液态水会放出55.625kJ的热量,试写出甲烷燃烧的热化学方程式:
查看习题详情和答案>>
(1)H2SO4 在上述反应中表现出来的性质是
A
A
(填选项字母,多选不得分) A.酸性 B.氧化性 C.吸水性 D.脱水性
(2)若 12g 储氢纳米碳管含碳纳米颗粒的质量分数为 30%,除去这些杂质需要0.1mol/L的K2Cr2O7 洛液
2
2
L;(3)在常温下,该反应所需的硫酸溶液 pH=a,它与 pH=b 的 NaOH 溶液按体积比 1:100 混合刚好成中性,则 a 与 b 的关系式为:
a+b=12
a+b=12
(用 a、b 字母表示〕;(4)合成储氢纳米碳管的碳主要由甲烷热分解获得,川东地区新近发现一大型天然气田,为合成储氢纳米碳管工业生产提供了丰富的原料,同时天然气又是一种重要的能源,1g 甲烷燃烧生成液态水会放出55.625kJ的热量,试写出甲烷燃烧的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890KJ/mol
CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890KJ/mol
.