网址:http://m.1010jiajiao.com/timu3_id_419608[举报]
已知可逆反应:Fe(s) + CO2(g)![]() FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如右图所示。
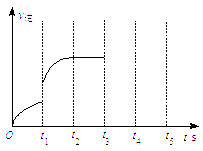
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图![]() 画出t3~ t5时间段的v逆变化曲线。
画出t3~ t5时间段的v逆变化曲线。
③能作为判断该反应达到平衡状态的依据是 (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
查看习题详情和答案>>(8分)已知可逆反应:Fe(s) + CO2(g)![]() FeO(s)+ CO(g),其温度与平衡常数K的关系如下表:
FeO(s)+ CO(g),其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如右图所示。
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~t5时间段的v逆变化曲线。
③能作为判断该反应达到平衡状态的依据是 (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
查看习题详情和答案>>
(8分)已知可逆反应:Fe(s) + CO2(g) FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如右图所示。
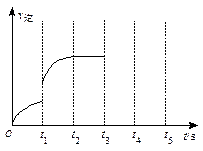
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图
 画出t3~ t5时间段的v逆变化曲线。
画出t3~ t5时间段的v逆变化曲线。③能作为判断该反应达到平衡状态的依据是 (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快 查看习题详情和答案>>
(8分)已知可逆反应:Fe(s) + CO2(g) FeO(s)
+ CO(g),其温度与平衡常数K的关系如下表:
FeO(s)
+ CO(g),其温度与平衡常数K的关系如下表:
|
T(K) |
938 |
1173 |
|
K |
1.47 |
2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如右图所示。
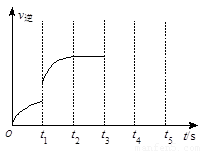
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线。
③能作为判断该反应达到平衡状态的依据是 (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
查看习题详情和答案>>
 FeO(s)+CO(g),其温度与平衡常数K的关系如下表:
FeO(s)+CO(g),其温度与平衡常数K的关系如下表: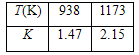
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、 “减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如图所示。
①从下图可知,在t1时改变了某种反应条件,反应在 t2时达到平衡,改变的条件可能是_______(选填编号)。
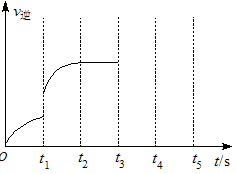
③能作为判断该反应达到平衡状态的依据是________(选填编号)。
a.v正(CO2)=v逆(CO)
b.容器内气体总压强不再变化
c.容器内气体密度不再变化
d.使用催化剂后,正、逆反应速率同比例加快