网址:http://m.1010jiajiao.com/timu3_id_419279[举报]
(1)工业高炉炼铁采用焦炭、铁矿石等于高炉中共热,并鼓入适量空气,让高温下产生的CO气体还原铁矿石制得铁。这种方法不可避免地混入了非金属单质——碳。纯铁的抗腐蚀能力相当强,而铁碳合金却易发生电化腐蚀。
①写出钢铁发生吸氧腐蚀时的正极反应____________________________________。
②为保护钢铁制品不被腐蚀,可采用的电化学防护方法是(答出一种电化学防护方法的名称)____________________________________。
(2)焊接无缝钢轨时常采用铝热反应制备铁,中学教材中也有Al和Fe2O3的铝热反应实验。
①有人推测,铝热反应实验中所得熔融物中可能混有Al。若用一个简单实验证明含Al,则应选用的试剂是____________,能证明含铝的现象是__________________________。
②若经实验证实熔融物含铝,欲将该熔融物完全溶解,下列试剂中最适宜的是____________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀HNO3 D.NaOH溶液
③实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,直到还原成铵根离子(![]() )。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:
)。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:

试回答下列问题:
Ⅰ.图中DE段沉淀的物质的量没有变化,此段发生反应的离子方程式为_________________。
Ⅱ.通过图象判断溶液中的离子结合OH-能力最强的是________________,最弱的是________________。
Ⅲ.EF段反应的离子方程式是________________,A与B 的差值是________________mol。
查看习题详情和答案>>铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。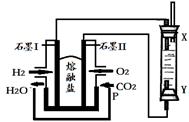
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+
 O2(g)
O2(g)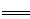 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1 C(s)+O2(g)
 CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-12C(s)+O2(g)
 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1则高炉炼铁过程中 FeO(s)+CO(g)
 Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
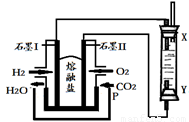
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看习题详情和答案>>