摘要:8. (1) 2Cl2+C+2H2O4HCl +CO2 提供D处所需的水蒸气 (2)石蕊试液先变红色.后变无色 生成的HCl使石蕊试液变红.未反应完的Cl2 与H2O作用产生HClO,HClO的漂白作用使红色消失 瓶中液面下降.长颈漏斗内液面上升 瓶中的气体呈黄绿色 贮存少量 Cl2.避免Cl2 对环境的污染 课后练习 1D 2B 3B
网址:http://m.1010jiajiao.com/timu3_id_41906[举报]
下列说法及对应的离子方程式均正确的是
A.铁溶于稀HNO3,溶液变黄色:3Fe + 8H+ + 2NO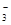 =
3Fe2+ + 2NO↑ + 4H2O
=
3Fe2+ + 2NO↑ + 4H2O
B.用惰性电极电解AlCl3溶液:Al3+ + 3Cl- + 3H2O  Al(OH)3↓
+ 3/2H2↑ + 3/2Cl2↑
Al(OH)3↓
+ 3/2H2↑ + 3/2Cl2↑
C.用酚酞作指示剂,在Na2CO3溶液中滴入乙酸溶液:CO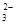 +
2CH3COOH = 2CH3COO- + H2O + CO2↑
+
2CH3COOH = 2CH3COO- + H2O + CO2↑
D.在K2Cr2O7溶液中滴入NaOH溶液,溶液变为橙色:Cr2O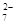 (橙)+ H2O
(橙)+ H2O  2CrO
2CrO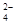 (黄)+2H+
(黄)+2H+
查看习题详情和答案>>
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:

根据要求填空:
(1)B装置有三种功能:①控制气流速度;②
(2)D装置中的石棉上均匀附着KI粉末,其作用是
(3)E装置的作用是
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方为
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4.
查看习题详情和答案>>

根据要求填空:
(1)B装置有三种功能:①控制气流速度;②
使气体混合均匀
使气体混合均匀
;③干燥气体
干燥气体
;(2)D装置中的石棉上均匀附着KI粉末,其作用是
吸收过量的Cl2;
吸收过量的Cl2;
(3)E装置的作用是
CD
CD
(填编号);A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式
CH4+2Cl2→C+4HCl
CH4+2Cl2→C+4HCl
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方为
分液
分液
.该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是AB
AB
(填编号)A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4.
 如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.(1)要将C装置接入B和D之间,正确的接法是:a→
c
c
→b
b
→d.实验开始之前,如何检查AB装置的气密性?
关闭K和A中分液漏斗的活塞,微热圆底烧瓶,B中长颈漏斗液面升高,停止加热后,长颈漏斗液面恢复至原位,则AB气密性良好.或关闭K,往分液漏斗中不断加水至没过分液漏斗口,若B中长颈漏斗液面升高,且静置一段时间后高度保持不变,则AB气密性良好
关闭K和A中分液漏斗的活塞,微热圆底烧瓶,B中长颈漏斗液面升高,停止加热后,长颈漏斗液面恢复至原位,则AB气密性良好.或关闭K,往分液漏斗中不断加水至没过分液漏斗口,若B中长颈漏斗液面升高,且静置一段时间后高度保持不变,则AB气密性良好
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯.Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为
2Cl2+C+2H2O(g)
4HCl+CO2
| ||
2Cl2+C+2H2O(g)
4HCl+CO2
.为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是
| ||
加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要
加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要
.(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是
瓶中液面下降,长颈漏斗内液面上升
瓶中液面下降,长颈漏斗内液面上升
,B的作用是贮存少量Cl2,避免Cl2对环境造成污染
贮存少量Cl2,避免Cl2对环境造成污染
.(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图
D中反应生成的HCl气体极易溶于水,易发生倒吸,

D中反应生成的HCl气体极易溶于水,易发生倒吸,
.
下图是一个制取氯气并以氯气为原料进行特定反应的装置;已知Cl2在饱和食盐水中的溶解性非常小.

(1)A是氯气发生装置,其中发生反应的化学方程式为:
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精打,连接上E装置.Cl2通过C瓶后再进入D.D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl.试写出D中反应的化学方程式:
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为:
A、有白色沉淀生成 B、无明显现象 C、先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是:
(6)若实验中使用12mol/L的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是
查看习题详情和答案>>

(1)A是氯气发生装置,其中发生反应的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精打,连接上E装置.Cl2通过C瓶后再进入D.D装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl.试写出D中反应的化学方程式:
H2O+2Cl2+C
4HCl+CO2;
| ||
H2O+2Cl2+C
4HCl+CO2;
.装置C的作用是:
| ||
提供参加反应的水
提供参加反应的水
.(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
因反应中产生盐酸,所以石蕊试液变红,又因为剩余的氯气也可以和水反应生成盐酸和次氯酸,次氯酸又有漂白性,所以变为无色.
因反应中产生盐酸,所以石蕊试液变红,又因为剩余的氯气也可以和水反应生成盐酸和次氯酸,次氯酸又有漂白性,所以变为无色.
.(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为:
B
B
A、有白色沉淀生成 B、无明显现象 C、先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是:
B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体
B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体
,B的作用是:收集和储存剩余的氯气.
收集和储存剩余的氯气.
.(6)若实验中使用12mol/L的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是
浓盐酸有挥发性;稀盐酸也不发生该反应.
浓盐酸有挥发性;稀盐酸也不发生该反应.
. O2(g) === CO2(g)
△H=-283.0 kJ•mol-1
O2(g) === CO2(g)
△H=-283.0 kJ•mol-1