网址:http://m.1010jiajiao.com/timu3_id_418819[举报]
黄铁矿(主要成分为FeS2)是生产硫酸的主要原料.高温时,黄铁矿在空气中煅烧[设空气中V(N2)∶V(O2)=4∶1且不含其他气体],可发生下列反应:
4FeS2+11O2根据题意完成下列计算:
1.若把2.00 g某黄铁矿试样在足量空气中充分灼烧后(杂质不反应、不挥发),得到1.56 g残渣,则该黄铁矿的纯度为________.
2.煅烧70t黄铁矿(含硫35%,杂质不含硫且不反应)生产出72.8t硫酸铵.若黄铁矿制取硫酸时的利用率为80%,则在制取硫酸铵时硫酸的利用率为________(答案保留两位小数).
3.为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,煅烧后的混合气体平均相对分子质量为________(答案保留两位小数).
4.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时生产副产品氮肥.已知吸收尾气后的氨水全部转化为铵盐.取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09 mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16 mol NH3,同时得到21.86 g沉淀.通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在____的郊区。(填选项的序号) A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应SO2(g)+1/2O2(g)=SO3(g);△H= -98.3kJ/mol-1放出的热量能在生产过程中得到充分利用,则每生产l t 98%的硫酸只需外界提供(或可向外 界输出)________千焦能量。
(3) CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3,和SO2,该反应的化学方程式为
______________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4 (由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)。

___________________
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
 Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )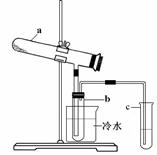
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。
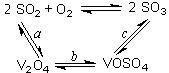
(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在_______的郊区(填选项的标号)。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2 (g) + 1/2O2 (g) ![]() SO3 (g) ;△H= -98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t 98%硫酸只需外界提供(或可向外界输出)多少kJ能量?
SO3 (g) ;△H= -98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t 98%硫酸只需外界提供(或可向外界输出)多少kJ能量?
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为_________________________________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO和SO3在沸腾炉中化合而成),其中CuSO4的质量分数随沸腾炉温度不同而变化(见下表)。
沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因。
[化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量.请通过计算判断,若反应:SO2(g)+ O2?SO3 △H=-98.3kJ?mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)______千焦能量(H2SO4的摩尔质量为98g?mol-1)
O2?SO3 △H=-98.3kJ?mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)______千焦能量(H2SO4的摩尔质量为98g?mol-1)
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为______.
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |