网址:http://m.1010jiajiao.com/timu3_id_418771[举报]
(1)制水煤气的主要化学反应方程式为:
| ||
| ||
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)+90.8kJ
②2CH3OH(g)?CH3OCH3(g)+H2O(g)+23.5kJ
③CO(g)+H2O(g)?CO2(g)+H2(g)+41.3kJ
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)+Q,其中Q=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
a.低温高压b.加入催化剂c.减少CO2的浓度d.增加CO的浓度
(4)已知某温度下反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
反应开始时c(CH3OH)=
Pb+PbO2+4H+
| ||
| 充电 |
(1)放电时,正极的电极反应式为
(2)工业用PbO2来制备KClO4的工业流程如下:
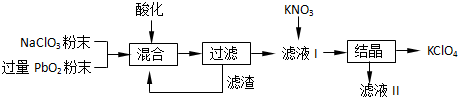
①写出NaClO3与PbO2反应的离子方程式:
②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是
(3)PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如图所示.
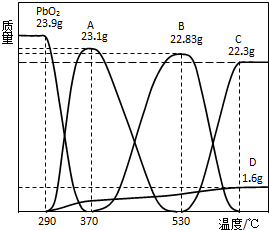
若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为
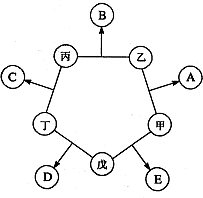 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.②乙在甲中燃烧发出苍白色火焰,戊在甲中燃烧生成棕黄色烟,E的水溶液呈黄色.
③常温下B、C均为无色气体,D为磁性黑色固体.
(1)D的化学式
(2)把戊加入到E的水溶液中,写出该反应的离子方程式
(3)工业上可由B与丁反应制取C,写出该反应的化学方程式
(4)将氯气和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇)  (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
查看习题详情和答案>>
1984年,地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
(1) “84消毒液”的有效成分是NaClO。其工业制法是利用Cl2与NaOH反应得到,请写出该反应的化学反应方程式_______________________;另外,电解NaCl溶液可直接制备84消毒液,通电时氯气被溶液完全吸收,请写出电解NaCl溶液的化学反应方程式___________。
(2)“84消毒液”可用于公共场所卫生洁具清理和染色白毛巾的处理,但不宜与其他洗涤液混用,尤其不能与洁厕灵混合,混合后容易发生的离子反应方程式是
___________________________。
(3)“84消毒液”本品在空气中露置一段时间会失效,试解释失效的主要原因
____________________________________________________________________。
查看习题详情和答案>>
 )
)