摘要:12.高温下某反应达到平衡.其平衡常数的表达式是:K= . 现采取了某一措施.并在过段时间后测得H2的浓度有所增大.由此得到的结论一定正确的是 ( ) (A)该反应的化学方程式为:CO+H2O CO2+H2 (B)无论采取怎样的措施该体系中混合气体的平均分子量都不会发生改变 (C)采取的措施一定是改变了温度.并使平衡朝着生成H2的方向移动 (D)采取的措施可能是改变了压强而导致H2的浓度有所增大
网址:http://m.1010jiajiao.com/timu3_id_418757[举报]
一定条件下,某反应达到平衡,其平衡常数为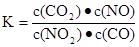 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
A. 该反应的化学方程式为:NO2+CO===CO2+NO
B. 该反应的焓变为负值
C. 升高温度,正反应速率减小
D. 恒温时,增大压强,颜色加深,因平衡左移
查看习题详情和答案>>
一定条件下,某反应达到平衡,其平衡常数为K=[c(CO2).c(NO)]/[c(NO2).c(CO)]恒容时升高温度,混合气体的颜色加深,下列说法不正确的是( )
查看习题详情和答案>>
| A.该反应的焓变为负值 |
| B.化学方程式为NO2(g)+CO(g)?CO2(g)+NO(g) |
| C.降温,正反应速率减小 |
| D.恒温时,增大压强颜色加深,平衡逆向移动 |
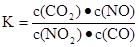 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是