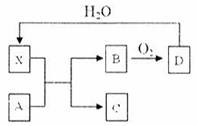
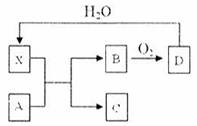
摘要:11. 已知①-④均为工业生产及应用的常见反应.其中常温下B.D.J.P气体.E为分子中原子个数比为1∶l的液体.A的相对分子质量为120. 试回答下列问题: (1) 反应F与N溶液反应的离子方程式为 , (2) 反应⑤中当有1mol电子转移时.氧化剂消耗 g. (3) 反应④的离子方程式为 , 右图是该反应原理的示意图.该装置中使用的是 离子交换膜.图中从d处收集到的是 . (4) 工业上由D制取I的过程可表示为: 由D与B反应生成X的反应所用的设备是 ①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔 已知400℃ 101Kpa时.2D2X(g),△H = – 196.6KJ/mol.当2 mol D与1 mol B在该条件下反应达平衡时反应放热186.8 KJ. 在实际生产中综合考虑各种因素.为提高D的转化率.工业选择了以下哪些条件 ①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物 ⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换
网址:http://m.1010jiajiao.com/timu3_id_418677[举报]
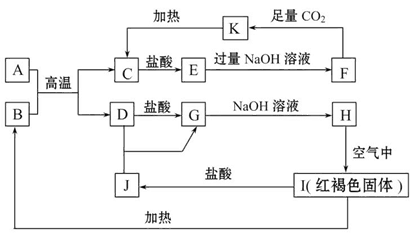
已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
请回答以下问题:
(1)A与B反应的化学方程式是:______________________________________。
(2)向F中通入足量CO2生成K的离子方程式为:_________________________。
(3)A与NaOH溶液反应的离子方程式是:_________________________________________________。
(4)①检验物质J的溶液中金属离子的方法是:_______________________________________________。
②将物质E溶于水,其溶液呈酸性,原因是(用离子方程式表示)____________。
③某高效净水剂是由D(OH)SO4聚合得到的。工业上以DSO4、稀硫酸和亚硝酸钠为原料来制备D(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。
已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
请回答以下问题:
(1)A与B反应的化学方程式是:______________________________________。
(2)向F中通入足量CO2生成K的离子方程式为:_________________________。
(3)A与NaOH溶液反应的离子方程式是:_________________________________________________。
(4)①检验物质J的溶液中金属离子的方法是:_______________________________________________。
②将物质E溶于水,其溶液呈酸性,原因是(用离子方程式表示)____________。
③某高效净水剂是由D(OH)SO4聚合得到的。工业上以DSO4、稀硫酸和亚硝酸钠为原料来制备D(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。

请回答以下问题:
(1)A与B反应的化学方程式是:______________________________________。
(2)向F中通入足量CO2生成K的离子方程式为:_________________________。
(3)A与NaOH溶液反应的离子方程式是:_________________________________________________。
(4)①检验物质J的溶液中金属离子的方法是:_______________________________________________。
②将物质E溶于水,其溶液呈酸性,原因是(用离子方程式表示)____________。
③某高效净水剂是由D(OH)SO4聚合得到的。工业上以DSO4、稀硫酸和亚硝酸钠为原料来制备D(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。
已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
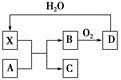

| A.X使蔗糖变黑的现象主要体现了X的脱水性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 |
| D.工业上,B转化为D的反应条件为高温、高压、使用催化剂 |