网址:http://m.1010jiajiao.com/timu3_id_418631[举报]
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+O2![]() 2NO为例)、人工固氮(以为N2+3H2
2NO为例)、人工固氮(以为N2+3H2![]() 2NH3 为例)反应的平衡常数
2NH3 为例)反应的平衡常数![]() 的值如下表。
的值如下表。
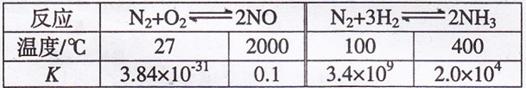
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ.mol-1
2NH3(g) △H=-92.4KJ.mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6KJ.mol-1
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
N2(g) + 3H2O(l)= 2NH3(g) +3/2O2(g)的 △H= KJ.mol-1
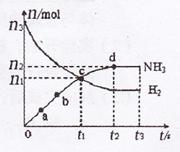
(3)某研究小组在673 K、30 MPa下,在体积为VL的密闭容器中进行反应:,N2(g)+3H2(g)![]() 2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
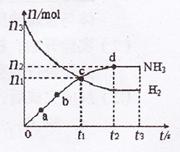
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)= .
③若开始时n(N2)= n(H2),则反应的平衡常数K= (用代数式表示).
查看习题详情和答案>>大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以![]() 为例)、人工固氮(以
为例)、人工固氮(以![]() 为
为
例)反应的平衡常数![]() 的值如下表。
的值如下表。
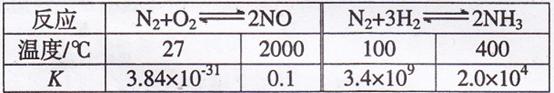
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:![]()
![]()
![]()
![]()
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
![]() +
+![]() =
=![]() +3/2
+3/2![]() 的
的![]()
![]()
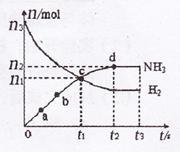 (3)某研究小组在673 K、30 MPa下,在体积为
(3)某研究小组在673 K、30 MPa下,在体积为![]() 的
的
密闭容器中进行反应:![]() ,
,
其![]() 和
和![]() 随时间变化的关系如图所示。
随时间变化的关系如图所示。
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则![]() 将增大
将增大
②从开始到平衡时反应的平均速率(以![]() 的浓度变化表示)v(
的浓度变化表示)v(![]() )= .
)= .
③若开始时![]() =
=![]() ,则反应的平衡常数K= (用代数式表示).
,则反应的平衡常数K= (用代数式表示).

力“人工固氮”新方法的研究。
(1)有关大气固氮(以
 为例)、人工固氮(以
为例)、人工固氮(以 为
为例)反应的平衡常数
 的值如下表。
的值如下表。
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:


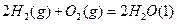

据报道,在常温、常压、光照、催化剂的条件下,
 可以与水反应,则反应
可以与水反应,则反应 +
+ =
= +3/2
+3/2 的
的

(3)某研究小组在673 K、30 MPa下,在体积为
 的
的密闭容器中进行反应:
 ,
,其
 和
和 随时间变化的关系如图所示。
随时间变化的关系如图所示。①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则
 将增大
将增大②从开始到平衡时反应的平均速率(以
 的浓度变化表示)v(
的浓度变化表示)v( )= .
)= .③若开始时
 =
= ,则反应的平衡常数K=(用代数式表示).
,则反应的平衡常数K=(用代数式表示).(10分)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以![]() 为例)、人工固氮(以
为例)、人工固氮(以![]() 为
为
例)反应的平衡常数![]() 的值如下表。
的值如下表。
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:![]()
![]()
![]()
![]()
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
![]() +
+![]() =
=![]() +3/2
+3/2![]() 的
的![]()
![]()
 (3)某研究小组在673 K、30 MPa下,在体积为
(3)某研究小组在673 K、30 MPa下,在体积为![]() 的
的
密闭容器中进行反应:![]() ,
,
其![]() 和
和![]() 随时间变化的关系如图所示。
随时间变化的关系如图所示。
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则![]() 将增大
将增大
②从开始到平衡时反应的平均速率(以![]() 的浓度变化表示)v(
的浓度变化表示)v(![]() )= .
)= .
③若开始时![]() =
=![]() ,则反应的平衡常数K= (用代数式表示).
,则反应的平衡常数K= (用代数式表示).
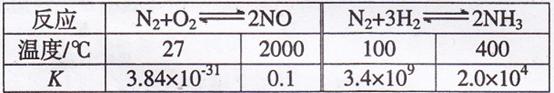
把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2  2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
表二:N2+ 3H2
 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
A、N2+ O2
 2NO是吸热反应
2NO是吸热反应B、人类大规模模拟大气固氮是没有意义的
C、在常温下,增加工业固氮的容器的压强,K值会发生改变
D、工业固氮是放热反应
(2)向某密闭容器中加入4 mol NH3、1.2 mol H2和一定量的N2三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知0~t1阶段保持恒温、恒容,且c(N2)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件。

①若t1="15" s,则t0~t1阶段的反应速率为v(H2)=
②N2的起始物质的量为
③反应达到平衡状态,下列说法中能表明已达到平衡状态的是
A、单位时间内生成a molN2,同时生成3a mol H2 B、容器的总压强不再变化
C、混合气体的密度不再变化 D、三个H—H 键断裂的同时有六个H—N键断裂
④t4时刻改变的条件为 ,t5时刻改变的条件为
⑤已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________________ 查看习题详情和答案>>