摘要:欲除去CuSO4酸性溶液中少量Fe3+.加入下列试剂效果最好的是 A.氨水 B. NaOH C.H2S水溶液 D.Cu2(OH)2CO3 4.元素X和Y在周期表中的相对位置如图所示.已知Y原子最外能层上电子排布为 nsn-1npn+1.则X的原子序数是 A.8 B.9 C.10 D.16
网址:http://m.1010jiajiao.com/timu3_id_418480[举报]
下列的实验方法正确的是( )
| A、除去CO2中少量O2:通过灼热的镁网后收集气体 | B、除去Al3+溶液中的少量Fe3+:加入用过量氨水 | C、配制FeCl3溶液:将FeCl3固体溶解于水中 | D、除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置 |
 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO
2- 4 |
粗盐溶解
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液
c.NaOH溶液 e.Ba(NO3)2溶液 d.BaCL2溶液
①欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO
2- 4 |
dca(或dac,或cda)
dca(或dac,或cda)
②蒸发时所用玻璃棒的作用是
搅拌,防止液体飞溅
搅拌,防止液体飞溅
,蒸发操作即将结束,当溶液中有大量晶体析出
溶液中有大量晶体析出
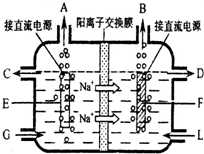
时,停止加热,熄灭酒精灯.(2)食盐是工业上生产氯气和烧碱的重要原料.右图是工业上电解饱和和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).
①B处出口产生的物质是
H2
H2
;G处进口的物质是精制的饱和食盐水
精制的饱和食盐水
.电解总反应的离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②如果开始就将直流电源的正负极与电极接反了,通电几分钟,在电极F附近可以观察到的现象是
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
.(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液.实验室在常温下电解饱和食盐水v1mL(密度为ρg/cm3),当收集到v2L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量分数计算式为
| ||
ρV1-
|
| ||
ρV1-
|
下列有关实验的叙述,正确的是(填序号)
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)在测定硫酸铜晶体里结晶水含量的实验中,称量操作至少需四次
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(I)在氢氧化铁胶体中加入少量硫酸会产生沉淀
(J)用结晶法可以除去硝酸钾中混有的少量氯化钠
(K)除去FeCl3酸性溶液中少量的FeCl2,加稍过量的双氧水后放置
(M)在制取干燥纯净的Cl2时,先使Cl2通过水(或饱和食盐水),后通过浓H2SO4.
查看习题详情和答案>>
BDGIJKM
BDGIJKM
.(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)在测定硫酸铜晶体里结晶水含量的实验中,称量操作至少需四次
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(I)在氢氧化铁胶体中加入少量硫酸会产生沉淀
(J)用结晶法可以除去硝酸钾中混有的少量氯化钠
(K)除去FeCl3酸性溶液中少量的FeCl2,加稍过量的双氧水后放置
(M)在制取干燥纯净的Cl2时,先使Cl2通过水(或饱和食盐水),后通过浓H2SO4.