摘要: (1)2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑ (2)2Fe3+ + 2e- 2Fe2+ (或Fe3+ + e- Fe2+) 图略 溶液变为蓝色 2Fe3+ + 2I- = 2Fe2+ + I2 (4)加热浓缩.冷却结晶.过滤 干燥的HCl气流 Al3+ + 3H2O Al(OH)3 + 3H+ .在干燥的HCl气流中.抑制AlCl3的水解.且带走AlCl3·6H2O晶体受热产生的水气.故能得到AlCl3.
网址:http://m.1010jiajiao.com/timu3_id_418428[举报]
物质A~K的转化关系如图所示,已知A是由两种元素组成的化合物;B是非金属单质;J是金属单质.H的相对分子质量比D大16(部分反应物、生成物未列出).
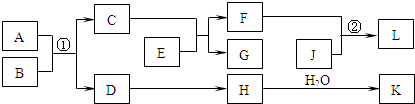
依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应.
(1)G的电子式是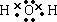
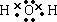 ;
;
(2)工业上反应①在
(3)反应①的化学方程式为
Ⅱ.若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同.
(4)物质A的分子式是
(5)反应②的离子方程式为
查看习题详情和答案>>

依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应.
(1)G的电子式是
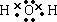
(2)工业上反应①在
沸腾炉
沸腾炉
(填工业设备名称)中进行;(3)反应①的化学方程式为
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
;
| ||
Ⅱ.若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同.
(4)物质A的分子式是
NH3
NH3
;(5)反应②的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.某同学查阅资料后发现对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸B.稀硫酸 C.稀硝酸 D.NaOH溶液.
查看习题详情和答案>>
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2050 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
合理
合理
(填“合理”或“不合理”);(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
NaOH溶液
NaOH溶液
,反应的离子方程式2Al+2OH-+H2O=2AlO2-+3H2↑
2Al+2OH-+H2O=2AlO2-+3H2↑
;(3)实验室溶解该熔融物,下列试剂中最好的是
B
B
(填序号).A.浓硫酸B.稀硫酸 C.稀硝酸 D.NaOH溶液.
已知①~④均为工业生产及应用的常见反应.其中常温下B、D、J、P气体,E为分子中原子个数比为1:l的液体.A的相对分子质量为120.(个别反应的产物已略去)
试回答下列问题:
(1)反应F与N溶液反应的离子方程式为
(2)反应⑤中当有1mol电子转移时,氧化剂消耗
(3)反应④的离子方程式为
(4)工业上由D制取I的过程可表示为:
由D与B反应生成X的反应所用的设备是
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃101Kpa时,2D(g)+B(g?2X(g);△H=-196.6KJ/mol,当2mol D与1mol B在该条件下反应达平衡时反应放热186.8KJ.在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件
①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物
⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换.
查看习题详情和答案>>

试回答下列问题:
(1)反应F与N溶液反应的离子方程式为
2Al+2OH-+2H20=2AlO2-+3H2↑
2Al+2OH-+2H20=2AlO2-+3H2↑
;(2)反应⑤中当有1mol电子转移时,氧化剂消耗
17g
17g
g;(3)反应④的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
;如图2是该反应原理的示意图,该装置中使用的是
| ||
阳
阳
(填“阴”或“阳”)离子交换膜,图中从d处收集到的是NaOH溶液
NaOH溶液
.(4)工业上由D制取I的过程可表示为:

由D与B反应生成X的反应所用的设备是
③
③
;①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃101Kpa时,2D(g)+B(g?2X(g);△H=-196.6KJ/mol,当2mol D与1mol B在该条件下反应达平衡时反应放热186.8KJ.在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件
④⑤⑥
④⑤⑥
.①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物
⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换.
(2010?石家庄模拟)回答下列有关周期表的问题:
(1)在图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界.
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式
 .
.
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式
查看习题详情和答案>>
(1)在图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界.

(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式


(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
2F2+2H2O═4HF+O2
2F2+2H2O═4HF+O2
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是
r(Ca2+)<r(Cl-)
r(Ca2+)<r(Cl-)
(用离子符号表示)(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题.
(1)A原子的最外层电子排布式
(2)写出C单质与强碱反应的离子方程式
(3)A,B两元素的氢化物分子中键能较小的是
(4)E、D同主族,位于短周期.它们的最高价氧化物中熔点较低的是
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质常温下为固体,难溶于水易于溶CS2.能形成2种二元含氧酸. | 原子的M层有1个未成对的p电子.核外p电子总数大于7. | 单质曾被称为“银色的金子”.与锂形成的合金常用于航天飞行器.单质能溶强酸和强碱. | 原子核外电子层上s电子总数比p电子总数少2个.单质和氧化物均为空间网状晶体,具有很高的熔、沸点. |
3s23p4
3s23p4
,D原子共有14
14
种不同运动状态的电子;(2)写出C单质与强碱反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.B与C形成的化合物溶于水后,溶液的pH小于
小于
7;(填“大于”、“等于”或“小于”)(3)A,B两元素的氢化物分子中键能较小的是
H2S
H2S
;分子较稳定的是HCl
HCl
;(填分子式)(4)E、D同主族,位于短周期.它们的最高价氧化物中熔点较低的是
CO2
CO2
(填分子式或化学式),原因是CO2属于分子晶体,SiO2属于原子晶体
CO2属于分子晶体,SiO2属于原子晶体
.