摘要:5.(1)C+4HNO3===4NO2↑+CO2↑+2H2O (2)小于,不再给木炭加热后反应仍能维持较长时间 (3)炭块保持红热.试管内有红棕色气体生成 (4)试管内有红棕色气体生成.石灰水变浑浊,Ca2++2OH-+CO2=CaCO3↓+H2O, (5)摇动试管B.使上部的气体溶于石灰水.
网址:http://m.1010jiajiao.com/timu3_id_41825[举报]
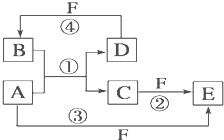 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)某同学记了有关硝酸的事实,你知道这些事实分别表现了硝酸的哪些性质?
请填空格:
(1)久置的硝酸显黄色:性质:
(2)铝制、铁制容器常温下可盛浓硝酸:性质:
(3)铜片放入在硝酸中,溶液变蓝,试管口有红棕色气体产生:性质:
(4)碳单质放入热的浓硝酸中产生大量的红棕色气体:性质:
(5)浓硝酸敞口放置在空气中,质量会减少:性质
查看习题详情和答案>>
请填空格:
(1)久置的硝酸显黄色:性质:
不稳定性
不稳定性
反应方程式为4HNO3═4NO2↑+O2↑+2H2O
4HNO3═4NO2↑+O2↑+2H2O
(2)铝制、铁制容器常温下可盛浓硝酸:性质:
强氧化性
强氧化性
(3)铜片放入在硝酸中,溶液变蓝,试管口有红棕色气体产生:性质:
强氧化性
强氧化性
、酸性
酸性
;有关反应的方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(4)碳单质放入热的浓硝酸中产生大量的红棕色气体:性质:
强氧化性
强氧化性
;有关反应方程式为C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
(5)浓硝酸敞口放置在空气中,质量会减少:性质
易挥发性
易挥发性
.短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13.已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数.
(1)C元素在元素周期表中的位置是
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是
(3)写出E2D2与A2D反应的离子方程式
(4)实验室配制100mL0.2mol?L-1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有
查看习题详情和答案>>
(1)C元素在元素周期表中的位置是
第二周期第ⅤA族
第二周期第ⅤA族
,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是
离子键、共价键
离子键、共价键
(3)写出E2D2与A2D反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(4)实验室配制100mL0.2mol?L-1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有
100mL容量瓶、玻璃棒、胶头滴管
100mL容量瓶、玻璃棒、胶头滴管
;如果定容时仰视刻度线,则所配制溶液浓度<
<
0.2mol?L-1(埴“>”、“<”或“=”).将F的单质溶于上述配制的溶液中所发生反应的离子方程式是2Al+2OH-+2H2O=+2AlO2-+3H2↑
2Al+2OH-+2H2O=+2AlO2-+3H2↑
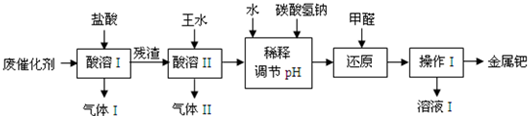
.(2012?虹口区二模)钯(Pd)是一种不活泼金属,性质与铂相似.在科研和工业生产中,含钯催化剂不仅用途广泛,且用量大,因此从废催化剂中回收钯具有巨大的经济效益.已知废催化剂的主要成分是钯和活性炭,还含有少量铁、锌.工业上采用如下流程从废催化剂中提取钯.
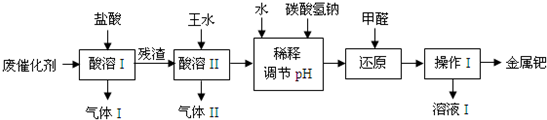
(1)气体I的化学式为
(2)王水指是浓硝酸和浓盐酸组成的混合物,其体积比为
a.Pd+HCl+HNO3→…
b.
(3)若用足量的烧碱吸收气体II,请写出吸收后溶液中含有的溶质的化学式:NaOH、
(4)写出用NaHCO3调节pH值时发生反应的离子方程式:
(5)操作I的名称是
(6)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,其目的是
查看习题详情和答案>>

(1)气体I的化学式为
H2
H2
,酸溶I的目的是除去铁、锌等杂质
除去铁、锌等杂质
.(2)王水指是浓硝酸和浓盐酸组成的混合物,其体积比为
1:3
1:3
.残渣与王水发生的反应有:a.Pd+HCl+HNO3→…
b.
C+4HNO3═CO2↑+4NO2↑+2H2O
C+4HNO3═CO2↑+4NO2↑+2H2O
(写出化学方程式并配平).(3)若用足量的烧碱吸收气体II,请写出吸收后溶液中含有的溶质的化学式:NaOH、
NaNO3
NaNO3
、NaNO2
NaNO2
、Na2CO3
Na2CO3
.(4)写出用NaHCO3调节pH值时发生反应的离子方程式:
HCO3-+H+═H2O+CO2↑
HCO3-+H+═H2O+CO2↑
.使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是酸性条件下,甲醛会被硝酸氧化
酸性条件下,甲醛会被硝酸氧化
.(5)操作I的名称是
过滤
过滤
,溶液I可能含有的有机离子为HCOO-
HCOO-
.(6)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,其目的是
除去废催化剂中的活性炭,减少王水的消耗
除去废催化剂中的活性炭,减少王水的消耗
.