摘要:1.C 2.D 3.C
网址:http://m.1010jiajiao.com/timu3_id_41823[举报]
Ⅰ.下列叙述正确的是.
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)
2SO3(g)△H<0
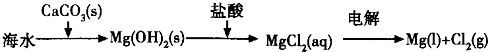
B.海水提镁的主要步骤为:
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
Ⅱ.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为
②硫酸钠和焦炭、石灰石反应的化学方程式为
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.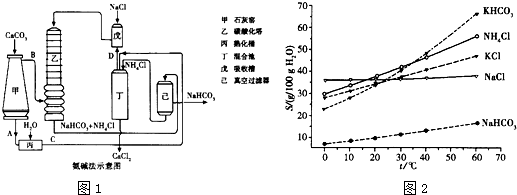
①图中的中间产物C是
②装置乙中发生反应的化学方程式为
(3)联合制碱法是对氨碱法的改进,其优点是
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合图1的溶解度(S)随温度变化曲线,分析说明是否可行?
查看习题详情和答案>>
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)
| 催化剂 |
| △ |
B.海水提镁的主要步骤为:

C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
Ⅱ.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为
2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
| ||
2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
;
| ||
②硫酸钠和焦炭、石灰石反应的化学方程式为
Na2SO4+2C+CaCO3
CaS+Na2CO3+CO2↑
| ||
Na2SO4+2C+CaCO3
CaS+Na2CO3+CO2↑
(已知产物之一为CaS);
| ||
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.

①图中的中间产物C是
Ca(OH)2
Ca(OH)2
,D是NH3
NH3
(写化学式);②装置乙中发生反应的化学方程式为
CO2+H2O+NH3=NaHCO3↓+NH4Cl
CO2+H2O+NH3=NaHCO3↓+NH4Cl
;(3)联合制碱法是对氨碱法的改进,其优点是
能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
;NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合图1的溶解度(S)随温度变化曲线,分析说明是否可行?
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
. Ⅰ.下列实验方案不可行的是:
Ⅰ.下列实验方案不可行的是:BCF
BCF
A.用品红溶液鉴别CO2和SO2气体 B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.用NH3和H2O做喷泉实验
E.除去 N2 中少量的O2用灼热的铜网 F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为
②①③⑧⑤⑥⑦④
②①③⑧⑤⑥⑦④
.(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响
偏低
偏低
.②某同学观察液面的情况如右图所示,则所配置的溶液的浓度
偏高
偏高
.(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
0.25mol/L
0.25mol/L
.Ⅰ.如图所示A~H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列问题:
(1)A仪器的名称是
(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
(4)实验过程中,装置Ⅳ中的实验现象为
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在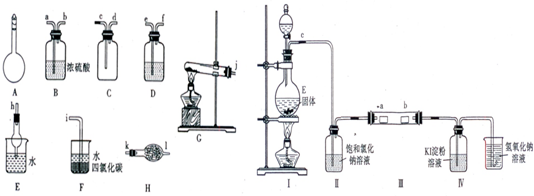
查看习题详情和答案>>
(1)A仪器的名称是
容量瓶
容量瓶
,常用于配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液
.(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
接k、l接d、c接h或I
接k、l接d、c接h或I
.Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
.(4)实验过程中,装置Ⅳ中的实验现象为
无色液体变蓝色
无色液体变蓝色
.(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在
Ⅱ、Ⅲ
Ⅱ、Ⅲ
之间(选填装置序号)还需添加一个洗气瓶,该装置的作用是干燥氯气
干燥氯气
.
Ⅰ.下面列出了几组物质,请将物质的合适组号填写在空格上.
A.金刚石与石墨; B.淀粉与纤维素; C.氕与氘;D.甲烷与戊烷;E.葡萄糖与果糖
F. G.
G. 
(1)同位素
Ⅱ.某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中的数据分析:
(1)该反应的化学方程式为
(2)反应开始至2min,用Z表示的平均反应速率为
(3)下列叙述能说明上述反应达到平衡状态的是
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化.
查看习题详情和答案>>
A.金刚石与石墨; B.淀粉与纤维素; C.氕与氘;D.甲烷与戊烷;E.葡萄糖与果糖
F.
 G.
G. 
(1)同位素
C
C
;(2)同素异形体A
A
;(3)同系物D
D
;(4)同分异构体EF
EF
;(5)同一物质G
G
.Ⅱ.某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中的数据分析:

(1)该反应的化学方程式为
3X+Y?2Z
3X+Y?2Z
.(2)反应开始至2min,用Z表示的平均反应速率为
0.05mol/(L?min)
0.05mol/(L?min)
.(3)下列叙述能说明上述反应达到平衡状态的是
BE
BE
(填序号)A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化.
Ⅰ.无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用如图装置制取无水氯化铝:
回答以下问题:
(1)装置D中发生的化学反应方程式:
(2)仪器X与仪器Y直接相连的意图是:①收集产物;②
(3)能否去掉E装置
(4)实验时应先点燃
Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂用0.100mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数是
查看习题详情和答案>>

回答以下问题:
(1)装置D中发生的化学反应方程式:
2Al+3Cl2
2AlCl3
| ||
2Al+3Cl2
2AlCl3
.
| ||
(2)仪器X与仪器Y直接相连的意图是:①收集产物;②
防止堵塞
防止堵塞
.(3)能否去掉E装置
不能
不能
原因是防止E中水汽与AlCl3作用
防止E中水汽与AlCl3作用
.(4)实验时应先点燃
A
A
处的酒精灯,其作用是用氯气排尽装置中的空气以防产品不纯
用氯气排尽装置中的空气以防产品不纯
.Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂用0.100mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为
ABDC或BADC
ABDC或BADC
(填字母).(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数是
60%
60%
%.