摘要: c-t图像:分清反应物和生成物.浓度减小的为反应物.浓度增大的为生成物.分清消耗浓度和增加浓度.反应物的消耗浓度和生成物的增加浓度之比.等于化学方程式中各物质的化学计量数之比. [练习5]今有X 2Z(g) △H<0.从反应 开始经过t1后达到平衡状态.t2 时由于条件改变.平衡受到破坏.在t3时又达到平衡.引起t2→t3曲线变化的原因是( ) A.增大X或Y的浓度 B.增大压强 C.增大Z的浓度 D.升高温度 [练习6]右图表示800℃时A.B.C三种气体物质的浓度随时间的变化情况.t1是到达平衡状态的时间.试回答: (1)该反应的反应物是 , (2)反应物的转化率是 , (3)该反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_41745[举报]
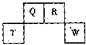 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的离子结构示意图为


(2)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
S+2H2SO4(浓)
3SO2+2H2O
| ||
S+2H2SO4(浓)
3SO2+2H2O
.
| ||
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
O2↑+2H2O
| ||
2H2O2
O2↑+2H2O
.
| ||
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子核外电子排布式是
1s22s22p63s23p3
1s22s22p63s23p3
.(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1mol P4时,就有
20
20
mol电子发生转移.II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(1)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
分解出HCl气体,抑制CeCl3的水解
分解出HCl气体,抑制CeCl3的水解
.(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
2
2
Ce3++1
1
H2O2+6
6
H2O→2
2
Ce(OH)4↓+6H+
6H+
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.
反应物A的浓度随时间的变化如图所示.
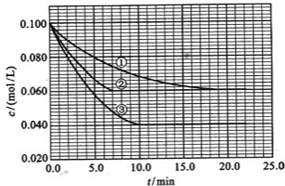
请回答下列问题:
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②
加催化剂
加催化剂
;达到平衡的时间缩短,平衡时A的浓度未变
达到平衡的时间缩短,平衡时A的浓度未变
.③
温度升高
温度升高
;达到平衡的时间缩短,平衡时A的浓度减小
达到平衡的时间缩短,平衡时A的浓度减小
.(4)实验②平衡时B的转化率为
40%
40%
;实验③平衡时C的浓度为0.06mol/L
0.06mol/L
;(5)该反应是
吸热
吸热
热反应,判断其理由是温度升高,平衡向正反应方向移动
温度升高,平衡向正反应方向移动
;(6)该反应进行到4.0min时的平均反应速度率:
实验②:VB=
0.014mol(L?min)-1
0.014mol(L?min)-1
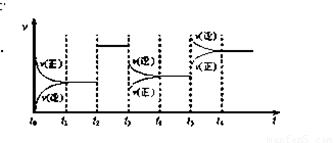
.某密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H
<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H
<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是

A.t3 时减小了压强
B.t5 时增大了压强
C.t6 时刻后反应物的转化率最低
D.t1 - t2 时该反应的平衡常数大于 t6 时反应的平衡常数
查看习题详情和答案>>
某密闭容器中发生如下反应:2X(g)+Y(g) Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
A.t3 时减小了压强
B.t5 时增大了压强
C.t6 时刻后反应物的转化率最低
D.t1 - t2 时该反应的平衡常数大于 t6 时反应的平衡常数
查看习题详情和答案>>
 Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是 
 Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是