摘要: 常温.物质的量浓度均为0.01mol·L-1的HA和MOH溶液.pH分别为3和12.将两溶液等体积混合后.所得溶液的pH为 ( ) A.≥7 B.一定>7 C.≤7 D.可能=7
网址:http://m.1010jiajiao.com/timu3_id_417296[举报]
下列说法正确的是( )
A.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
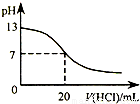
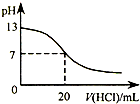
B.图表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化
C.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
查看习题详情和答案>>

A.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
B.图表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化
C.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
查看习题详情和答案>>
下列说法正确的是( )
查看习题详情和答案>>
| A.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
| B.图表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 |
| D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |

(2012?唐山二模)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
-28.5
-28.5
kJ?mol-1,炼铁反应平衡常数K随温度升高而减小
减小
(填“增大”、“不变”或“减小”).(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
60%
60%
.②下列说法正确的是
cd
cd
(填字母).a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
既含氧化亚铁又含氧化铁
既含氧化亚铁又含氧化铁
.②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
 (2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.
(2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.(1)已知373K时60s达到平衡,则前60s内A的平均反应速率为
0.01mol/L?s
0.01mol/L?s
.(2)该反应的平衡常数表达式为
| c2(B) |
| c(A) |
| c2(B) |
| c(A) |
(3)若在此平衡体系中再加入a mol的A,反应速率
增大
增大
(填“增大”或“减小”,下同),平衡时A的转化率减小
减小
.A的平衡浓度增大
增大
.(4)若373K时B的平衡浓度为A的2倍,473K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为
吸热反应
吸热反应
(填“放热反应”或“吸热反应”),为使该反应的平衡常数变小,可以采取的措施是c
c
.a.升高温度 b.扩大容器的体积
c.降低温度 d.将B从体系中抽走
(5)若反应在373K进行,在甲、乙两容器都为1L密闭容器,分别加入1mol B;1mol B、0.2mol He,达到平衡时B的转化率应
c
c
.a.甲>乙 b.乙>甲 c.甲=乙 d.无法确定.
 (2012?浙江模拟)下列说法正确的是( )
(2012?浙江模拟)下列说法正确的是( )