摘要:将一定量的镁铝合金投入到250ml.4mol/l的盐酸溶液中.金属完全溶解后.在加入2mol/l的NaOH溶液.若要生成沉淀最多.加入的这种NaOH溶液的体积是( ) A.250ml B.400ml C.500ml D.750ml
网址:http://m.1010jiajiao.com/timu3_id_41722[举报]
将一定量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol·L-1NaOH溶液直到过量,生成沉淀的质量与加入的NaOH体积关系如下图:

求(1)原合金中镁、铝的质量各是多少?
(2)盐酸的物质的量浓度是多少?
查看习题详情和答案>>
| |||||||||||||||
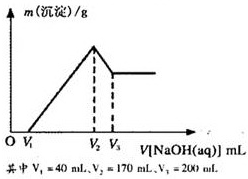 镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.
镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.(1)请写出V2→V3时,发生反应的化学方程式:
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
,由此计算出合金中铝的物质的量为0.15mol
0.15mol
.(2)计算合金中镁的质量.(要有计算过程,下同)
(3)合金在溶于稀硫酸时,释放出的气体体积(标准状况)是多少?
(4)康康同学所用稀硫酸的物质的量浓度是多少?
