网址:http://m.1010jiajiao.com/timu3_id_417141[举报]
 ⑥
⑥ ⑦
⑦ ⑧CH3OH ⑨HCOOH
⑧CH3OH ⑨HCOOH ⑩HOOC-COOH能够与H2无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
核磁共振氢谱是测定有机分子结构最有用的工具之一。在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同。根据峰值(信号)可以确定有机物中氢原子的种类。下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是( )
A.CH3OH B.CH3CH===CH2 C.CH3COOH D.CH3COCH3
查看习题详情和答案>>
下列说法正确的是
A.合成酚醛树脂的单体有CH3OH
B.红外光谱是确定有机分子摩尔质量的现代物理方法
C.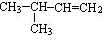 的名称为2-甲基-3-丁烯
的名称为2-甲基-3-丁烯
D.分子式为C7H8O且分子中有苯环的有机物多于4种
查看习题详情和答案>>
核磁共振氢谱是测定有机分子结构最有用的工具之一。在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同。根据峰值(信号)可以确定有机物中氢原子的种类。下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是( )
A.CH3OH B.CH3CH===CH2 C.CH3COOH D.CH3COCH3
查看习题详情和答案>>
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
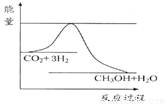
(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H= -116 kJ•mol-1;CO(g)+1/2O2(g)=CO2(g) △H=-283 kJ•mol-1 ;H2 (g)+1/2O2(g)=H2O(g) △H=-242 kJ•mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
查看习题详情和答案>>