网址:http://m.1010jiajiao.com/timu3_id_416052[举报]
| A、2C(H+)=C(Cl-)+C(OH-) | B、与等体积pH=12的一元碱MOH混合后所得溶液pH≥7 | C、由H2O电离出的C(H+)=1.0×10-2mol/L | D、与等体积0.01mol/L 乙酸钠混合后所得溶液中C(Cl-)=CCH3COO- |
A、2C+SiO2
| ||||
| B、Fe+H2SO4=Fe+H2↑ | ||||
| C、Br2+2NaI=2NaBr+I2 | ||||
D、2Al+Fe2O3
|
A、2C+O2
| ||||
B、2KClO3
| ||||
C、CaCO3
| ||||
| D、Zn+H2SO4(稀)=ZnSO4+H2↑ |
(11分)(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)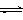 CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol H2 |
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来
 消除CO的污染。请你判
消除CO的污染。请你判 断是否可行并说出理由: , 。
查看习题详情和答案>>
断是否可行并说出理由: , 。
查看习题详情和答案>>
(16分)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O2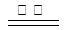 2ZnO+2SO2 ;鼓风炉中:2C +O2
2ZnO+2SO2 ;鼓风炉中:2C +O2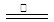 2CO
2CO
鼓风炉中:ZnO+CO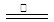 Zn
+ CO2
Zn
+ CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
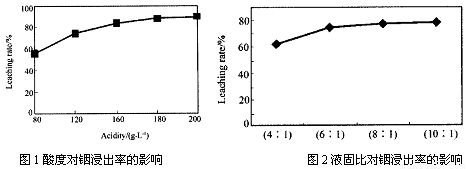
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法炼锌的主要工艺流程为

①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知CdO为碱性氧化物,Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 ___________ 、 。
查看习题详情和答案>>