网址:http://m.1010jiajiao.com/timu3_id_415602[举报]

(2)由实验I、Ⅱ两组数据可推测:取3.7g样品进行同样实验时,生成的氨气在标准状况下的体积为_______L。
(3)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(4)欲计算该NaOH溶液的物质的量浓度,应选择第I组和第_________组数据,由此求得NaOH溶液的物质的量浓度为 ___________。
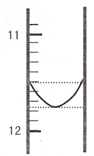 某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.(1)某同学平行滴定了三次,每次滴定从“0“点开始读数,其中第 I 次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是
(4)上述碱样中总碱量[n(Na2O)]是多少?写出计算过程
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
(07年四川卷)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。

请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________________________________________________________。
查看习题详情和答案>>某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol??L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
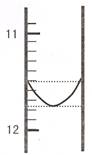
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
查看习题详情和答案>>[2012·天津卷](14分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
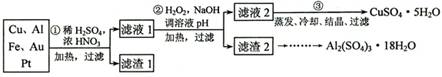
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
;调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
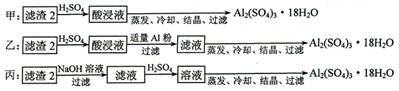
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看习题详情和答案>>