摘要:答案(1)[CO][H2O] [CO2][H2]830
网址:http://m.1010jiajiao.com/timu3_id_412730[举报]
符合如图所示的热化学方程式是 ( )
A、CO+H2O=CO2+H2;△H=+41 kJ/mol
B、CO(g)+H2O(g)=CO2(g)+H2(g);;△H= −41 kJ/mol
C、CO2(g)+H2(g)=CO(g)+H2O(g);△H=+41 kJ/mol
D、CO2(g)+H2(g)=CO(g)+H2O(g);△H=−41kJ/mol
【解析】根据图像可判断反应物的总能量低于生成物的总能量,反应是吸热反应。B、D不正确。在选项A中没有标明物质的状态,是错误的,所以正确的答案是C。
查看习题详情和答案>>
符合如图所示的热化学方程式是 ( )
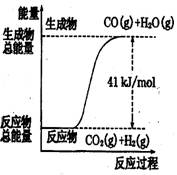
A、CO+H2O=CO2+H2;△H=+41 kJ/mol
B、CO(g)+H2O(g)=CO2(g)+H2(g);;△H= −41 kJ/mol
C、CO2(g)+H2(g)=CO(g)+H2O(g);△H=+41 kJ/mol
D、CO2(g)+H2(g) =CO(g)+H2O(g);△H=−41 kJ/mol
【解析】根据图像可判断反应物的总能量低于生成物的总能量,反应是吸热反应。B、D不正确。在选项A中没有标明物质的状态,是错误的,所以正确的答案是C。
查看习题详情和答案>>
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题
(1)该反应的化学平衡常数表达式为K=
.
(2)上述正向反应是:
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
(4)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
(6)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
查看习题详情和答案>>
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的化学平衡常数表达式为K=
| [H2]?[CO2] |
| [CO]?[H2O] |
| [H2]?[CO2] |
| [CO]?[H2O] |
(2)上述正向反应是:
放热
放热
反应(选填:放热、吸热).(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
逆
逆
反应方向移动(填“正”或“逆”),正反应速率增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强不变
不变
(填“增大”、“减小”或“不变”).(4)能判断该反应是否达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.(6)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
BC
BC
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
(2011?武汉模拟)某化学兴趣小组的同学通过査阅资料,获得了草酸的一些信息,整理出下表:
(1)该组同学欲通过实验验证草酸受热分解产物中的CO2和CO(装置符合气密性要求,其它试剂可自选).
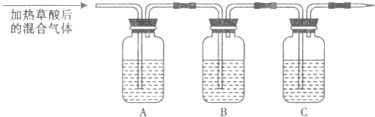
①填写表中空白.
②简述检验CO的实验方法和实验现象.
(2)实验室常用草酸钠测定KMnO4溶液的浓度.
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于
待测KMnO4溶液的物质的量浓度为
②将酸性高锰酸钾溶液和草酸溶液混合后,发现开始时溶液褪色不明显,但不久迅速褪色.针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液反应是放热反应,导致溶液温度升高,反应速率加快.你猜想还有可能是
查看习题详情和答案>>
| 结构简式 | HOOH-COOH | |||
| 溶解性 | 能溶于水,易溶于乙醇 | |||
| 特性 | 大约在157℃升华(175℃以上发生分解) | |||
| 化学性质 | H2C2O4+Ca(OH)2═CaC2O4↓+2H2O | |||
HOOC-COOH
| ||||
| 2KMnO4+5H2C2O4+3H2SO4═KSO4+2MnSO4+10CO2↑2O |

①填写表中空白.
| 仪器 | A | B | C |
| 加入试剂 | NaOH溶液 |
在C处后尖嘴管点燃气体,火焰呈蓝色,再用一个内壁附着澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
在C处后尖嘴管点燃气体,火焰呈蓝色,再用一个内壁附着澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
(2)实验室常用草酸钠测定KMnO4溶液的浓度.
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于
酸式
酸式
(填“酸式”或“碱式“)滴定管中进行滴定.重复上述滴定操作三次,实验数据如表所示.| 滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL |
0.08000 mol/L
0.08000 mol/L
.②将酸性高锰酸钾溶液和草酸溶液混合后,发现开始时溶液褪色不明显,但不久迅速褪色.针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液反应是放热反应,导致溶液温度升高,反应速率加快.你猜想还有可能是
催化剂(或Mn2+的催化作用)
催化剂(或Mn2+的催化作用)
的影响.若用实验证明你的猜想,除高锰酸钾溶液、草酸溶液、稀硫酸外,还需要选择的合理试剂是硫酸锰(或MnSO4)
硫酸锰(或MnSO4)
.