摘要:23.(1) (2) (3) (4)正极: 负极:
网址:http://m.1010jiajiao.com/timu3_id_411856[举报]
图一:长式周期表的一部分(编号代表对应元素)
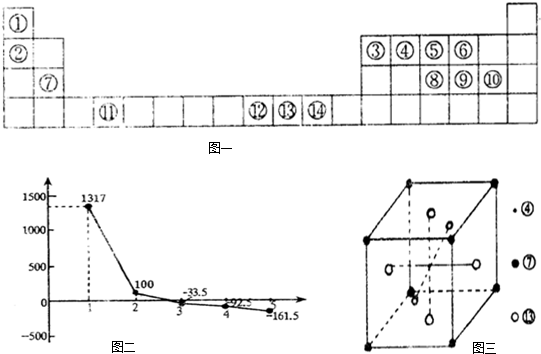
图二:②③④⑤⑥对应氢化物沸点
请回答下列问题:
(1)图一中属于P区的元素共有 种;原子核外有5种运动状态不同的电子,该元素名称是 ;14种元素中电负性最大的元素是 ;(填元素符号)
(2)科学家发现④⑦⒀三种元素形成的晶体有超导作用,其晶胞结构如图三所示,则该化合物化学式为 ;晶体中每个⑦原子周围距离最近且等距离的⑩原子有 个.
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,下列有关叙述正确的是 :(填字母)
A.X与水分子能形成氢键,Y是非极性分子
B.Y分子中每个碳含有2个σ键,1个π键
C.④⑥元素形成常见的化合物晶体熔点沸点都比SiO2晶体低,因为前者是分子晶体,后者是原子晶体.
D.X与CO2分子中的中心原子均采用SP3杂化
(4)图二中,系列3对应的氢化物中心原子杂化方式是 ;
系列1对应的氢化物沸点比其他氢化物高的原因是 ;
系列2对应的氢化物比系列3、4、5对应的氢化物沸点高的原因是 .
查看习题详情和答案>>

图二:②③④⑤⑥对应氢化物沸点
请回答下列问题:
(1)图一中属于P区的元素共有
(2)科学家发现④⑦⒀三种元素形成的晶体有超导作用,其晶胞结构如图三所示,则该化合物化学式为
(3)①④⑥三种元素组成的一种化合物X是新装修居室中的一种有害气体;①④二种元素形成原子个数比为1:1的化合物Y是一种常见的有机溶剂,下列有关叙述正确的是
A.X与水分子能形成氢键,Y是非极性分子
B.Y分子中每个碳含有2个σ键,1个π键
C.④⑥元素形成常见的化合物晶体熔点沸点都比SiO2晶体低,因为前者是分子晶体,后者是原子晶体.
D.X与CO2分子中的中心原子均采用SP3杂化
(4)图二中,系列3对应的氢化物中心原子杂化方式是
系列1对应的氢化物沸点比其他氢化物高的原因是
系列2对应的氢化物比系列3、4、5对应的氢化物沸点高的原因是
已知:短周期元素A、B、C、D、E原子序数依次增大.
(1)B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是______(用离子方程式表示).
(2)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙=______;
(3)盐丙中含有的化学键是______.
(4)0.1mol D单质和0.2mol E单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是______.
(5)反应:乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是______极(填“正”或“负”),在碱性条件下其电极反应是______.
(6)已知xC和yC是C元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是______.
A.xC2与yC2互为同分异构体
B.xC与yC核外电子排布方式不同
C.通过化学变化可以实现xC与yC间的相互转化
D.标准状况下,1.12L xC2和1.12L yC2均含有0.1NA个C原子.
查看习题详情和答案>>
| 元素代号 | 相关信息 |
| A | A与C可形成A2C和A2C2两种化合物 |
| B | B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D的单质能与冷水剧烈反应,得到强碱溶液 |
| E | 在第3周期元素中,E的简单离子半径最小 |
(2)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙=______;
(3)盐丙中含有的化学键是______.
(4)0.1mol D单质和0.2mol E单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是______.
(5)反应:乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是______极(填“正”或“负”),在碱性条件下其电极反应是______.
(6)已知xC和yC是C元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是______.
A.xC2与yC2互为同分异构体
B.xC与yC核外电子排布方式不同
C.通过化学变化可以实现xC与yC间的相互转化
D.标准状况下,1.12L xC2和1.12L yC2均含有0.1NA个C原子.
已知:短周期元素A、B、C、D、E原子序数依次增大.
(1)B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是______(用离子方程式表示).
(2)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙=______;
(3)盐丙中含有的化学键是______.
(4)0.1mol D单质和0.2mol E单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是______.
(5)反应:乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是______极(填“正”或“负”),在碱性条件下其电极反应是______.
(6)已知xC和yC是C元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是______.
A.xC2与yC2互为同分异构体
B.xC与yC核外电子排布方式不同
C.通过化学变化可以实现xC与yC间的相互转化
D.标准状况下,1.12L xC2和1.12L yC2均含有0.1NA个C原子.
查看习题详情和答案>>
| 元素代号 | 相关信息 |
| A | A与C可形成A2C和A2C2两种化合物 |
| B | B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D的单质能与冷水剧烈反应,得到强碱溶液 |
| E | 在第3周期元素中,E的简单离子半径最小 |
(2)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙=______;
(3)盐丙中含有的化学键是______.
(4)0.1mol D单质和0.2mol E单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是______.
(5)反应:乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是______极(填“正”或“负”),在碱性条件下其电极反应是______.
(6)已知xC和yC是C元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是______.
A.xC2与yC2互为同分异构体
B.xC与yC核外电子排布方式不同
C.通过化学变化可以实现xC与yC间的相互转化
D.标准状况下,1.12L xC2和1.12L yC2均含有0.1NA个C原子.
查看习题详情和答案>>