网址:http://m.1010jiajiao.com/timu3_id_411027[举报]
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
(2)用氢作为能源亟待解决的又一问题是贮氢材料的开发,研究表明某些过渡金属镧(La)、钯(Pd)能与氢原子形成氢化物,氢原子填充在金属晶体内的间隙之间,其组成不固定,通常是非化学计量的,如镧的氢化物的化学式可表示为LaH2.76.已知钯粉的密度为10.64g/cm3,相对原子质量为106.4,1体积的钯粉大约可吸附标准状况下896体积的氢气,则钯的氢化物的化学式为
(3)因氢气易燃易爆,贮运安全极为重要.已知氢气的燃烧热为285.8kJ?mol-1.
写出其完全燃烧的热化学方程式:
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
(2)因氢气易燃易爆,贮运安全极为重要.已知氢气的燃烧热为285.8kJ?mol-1.写出其完全燃烧的热化学方程式:
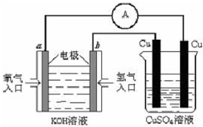
(3)氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行右图所示实验:①氢氧燃料电池中,正极的电极反应式为
②如图装置中,某一铜电极的质量减轻 3.2g,则 a 极上消耗的O2在标准状况下的体积为
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.则正极附近的pH
( )
A.CO燃烧的热化学方程式为:2CO(g)+O2(g)![]() 2CO2(g) ΔH=+282.8 kJ·mol-1
2CO2(g) ΔH=+282.8 kJ·mol-1
B.H2燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ·mol-1
2H2O(g) ΔH=-571.6 kJ·mol-1
C.燃烧前混合气体中H2的体积分数为50%
D.燃烧后的混合气体与足量的过氧化钠作用可产生1.25 mol氧气
查看习题详情和答案>>下列说法或表示方法正确的是( )
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度
B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定
C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
D.2A (l) + B (l) = 2C (l) △H1 2A (g) + B (g) = 2C (l) △H2 则ΔH1>ΔH2
查看习题详情和答案>>
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H=???????????????????????? 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为?????????????????? 。
②反应在第6 min时改变了条件,改变的条件可能是????????? (填序号)。
A.使用催化剂????? B.升高温度? C.减小压强????? D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____????? 。
②该电池正极的电极反应式为:???????????????????????? 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是?????????????????????????????????? (用相关的离子方程式表示)。

查看习题详情和答案>>