网址:http://m.1010jiajiao.com/timu3_id_410791[举报]
Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)As的价层电子构型为
(2)AlCl3 是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子的成键类型是
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(4)Si和C同主族,Si、C和O成键情况如下:
| C―O | C=O | Si―O | Si=O | |
| 键能/kJ?mol―1 | 360 | 803 | 464 | 640 |
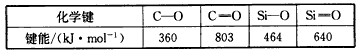
在C和O之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是
。
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H2O(l)配位而剧烈水解,再潮湿的空气中发烟,试用化学方程式表示其原理
查看习题详情和答案>>(1)As的价电子排布式为____________。
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,Al2Cl6中化学键类型是____________。
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与____个N原子相连,与同一个Al原子相连的N原子构成的空间构型为_________。在四大晶体类型中,
AlN属于____晶体。
(4)Si和C同主族,Si、C和O成键情况如下
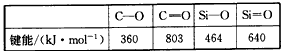
(5)SiCl4(液)常用作烟雾剂,原因Si存在3d轨道,能同H2O(液)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理_____________________。
(1)As的价电子排布式为______________。
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子的成键类型是________。
(3)Si和C同主族,Si、C和O成键情况如下
(1)写出As在周期表中的位置_____________,其价电子的电子排布式为____________________ ;
(2)Ge与As,哪种元素的第一电离能大?________原因是______________________;
(3)AlCl3是化工生产中常用的催化剂,熔点为192.6℃,熔融状态是通过配位键形成二聚体Al2Cl6 ,请画出Al2Cl6结构图示______________________;
(4)超高导热绝缘材料纳密氮化铝(AlN)在绝缘材料中应用广泛,其晶体结构与金刚石类似。则每个Al原子与______个N原子相连,与同一个Al原子相连的N原子构成的空间构型为________。氮化铝(AlN)与金刚砂(SiN)相比,晶体溶沸点较高的是____________,原因是____________________________。
(5)液态SiCl4常用作烟雾剂,原因是Si的3d空轨道能与水配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其发烟原理________________________。
(1)As的价电子排布式为____。
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,Al2Cl6中化学键类型是____。
(3)超高导热绝缘耐高温纳米氮化铝(A1N)在绝缘材料中的应用广泛,A1N晶体与金刚石类似,每个Al 原子与____个N原子相连,与同一个Al原子相连的N原子构成的空间构型为____。在四大晶体类型中,A1N属于____晶体。
(4)Si和C同主族,Si、C和O成键情况如下:
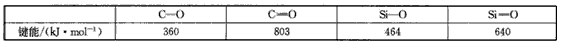
(5) SiCl4(液)常用作烟雾剂,原因是Si存在3d轨道,能同H2O(液)配位而剧烈水解,在潮湿的空气中发 烟,试用化学方程式表示其原理_________。