网址:http://m.1010jiajiao.com/timu3_id_410132[举报]
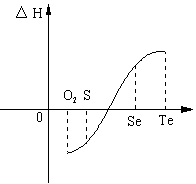
某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1mol H2反应热如下表所示。
| 物质 | O2 | S | Se | Te |
| △H(kJ?mol-1) | -242 | -20 | 81 |
|
请回答下列问题:
(1)写出氧族元素中含有的18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生反应的热化学方程式: 。
(3)一定温度下,在容积均为1L(容器容积不可变)的甲、乙两个容器中,分别充入2molSO2、 1molO2和4molSO2、2mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和a(乙),则此时a(乙)________50%(填“大于”“小于”或“等于”)。
查看习题详情和答案>>某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应的焓变(△H)情况如下表所示。
| 物质 | O2 | S | Se | Te |
| ΔH(kJ·mol-1) | -242 | -20 | 81 |
请回答下列问题:
(1)写出氧族元素中含有18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生分解反应的热化学方程式: 。
(3)已知H2Te分解反应的ΔS>0,ΔH=-154 kJ·mol-1,请解释Te和H2不能直接化合的原因
。
(4)H2S的水溶液显弱酸性,写出其电离方程式 ;它的第一级电离常数可用Ka1来表示,当温度升高时,Ka1的值 (填“一定增大”、“一定减小”或“不能确定”)。
(5)在容积均为1 L(容器![]() 体积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 molO2 和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和α(乙),则反应的平衡常数Kc= L·mol-1(填写具体数据),此时α(乙) 50%(填“大于”、“小于”或“等于”)。
体积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 molO2 和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和α(乙),则反应的平衡常数Kc= L·mol-1(填写具体数据),此时α(乙) 50%(填“大于”、“小于”或“等于”)。
某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应的焓变(△H)情况如下表所示。
| 物质 | O2 | S | Se | Te |
| ΔH(kJ·mol-1) | -242 | -20 | 81 |
| |||||||||||||||||||