摘要:21. (1)对于下列反应:2SO2 + O2 2SO3 . 如果2min内SO2的浓度由6 mol/L下降为2 mol/L.那么.用SO2浓度变化来表示的化学反应速率为 .用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L.2min后反应达平衡.若这段时间内v(O2)为0.5mol/.那么2min时SO2的浓度为 . (2)下图左表示在密闭容器中反应:2SO2+O22SO3 △H<0.达到平衡时. 由于条件改变而引起 反应速度和化学平衡 的变化情况.a b过 程中改变的条件可能 是 , b c过程中改变的条件 可能是 , 若增大压强时.反应速度变化情况画在c~d处.
网址:http://m.1010jiajiao.com/timu3_id_409878[举报]
 (1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为2mol/(L?min)
2mol/(L?min)
,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为2mol/L
2mol/L
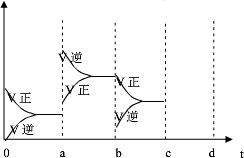
.(2)如图表示在密闭容器中反应:2SO2+O2?2SO3放热反应,达到平衡时,由于条件改变而引起反应速度的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处.
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为

(2)图1表示在密闭容器中反应:2SO2+O2?2SO3,△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,图2表示酶参加的反应中,温度与反应速率的关系.解释曲线变化原因
查看习题详情和答案>>
2mol/(L?min)
2mol/(L?min)
,用O2浓度变化来表示的反应速率为1mol/(L?min)
1mol/(L?min)
.如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为2mol/L
2mol/L
.
(2)图1表示在密闭容器中反应:2SO2+O2?2SO3,△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
升高温度
升高温度
;b c过程中改变的条件可能是减小SO3浓度
减小SO3浓度
; 若增大压强时,反应速度变化情况画在c~d处.(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,图2表示酶参加的反应中,温度与反应速率的关系.解释曲线变化原因
开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低
开始时温度升高及酶的催化作用增强使反应速率加快,但温度高至一定程度时,酶蛋白受热凝固变性而逐步失去催化活性,所以速率又降低
.(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是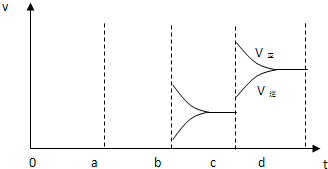
 .
.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
查看习题详情和答案>>
2mol/(L?min)
2mol/(L?min)
,用O2浓度变化来表示的反应速率为1mol/(L?min)
1mol/(L?min)
.
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
升温
升温
;b c过程中改变的条件可能是减小SO3浓度
减小SO3浓度
; 若增大压强时,反应速度变化情况画在c~d处

(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
在氯水中存在平衡:Cl2+H2O?HCl+HClO,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸
在氯水中存在平衡:Cl2+H2O?HCl+HClO,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸
. 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 2SO3
, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________
mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
2SO3
, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________
mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。