摘要:17.已知:2Al(OH)2(s)===Al2O3(s)+3H2O(g) ,△H= +175.4kJ·mol-1.因此Al(OH)3常用做无机阻燃剂.下列有关说法中不正确的是 A.将Al2O3和水混合共热后可以生成Al(OH)3 B.Al(OH)3受热分解过程中大量吸热.能阻止燃烧物品温度上升 C.Al(OH)3分解产生的水蒸气能稀释可燃性气体.生成的氧化物覆盖于物品上.阻止燃烧 D.与氟氯代烃阻燃剂相比.Al(OH)3做阻燃剂对环境的污染小
网址:http://m.1010jiajiao.com/timu3_id_408004[举报]
在一定温度下,向一容积为2L升的恒容密闭容器内加入0.2mol的N2和0.6mol的H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
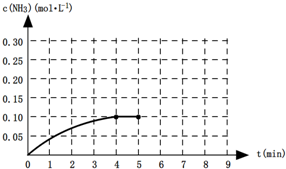
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)= .
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (选填字母编号).
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为 .反应达到平衡后,第5分钟时,若保持其它条件不变,只把容器的体积缩小一半,平衡 移动(选填“正向”、“逆向”或“不”),化学平衡常数K (选填“增大”、“减小”或“不变”).
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象 ,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33).
查看习题详情和答案>>

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象
 已知Ba【Al(OH)4】2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba【Al(OH)4】2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
查看习题详情和答案>>
(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是 92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是 .
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为 .向此溶液中加入少量的氯化铵固体,此时
值将 (填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=
水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度.为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟.
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸.
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤.
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置.
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解.
步骤6:滴定:用0.1000mol?L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL.反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式:
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol?L-1,pH≥
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程).
查看习题详情和答案>>
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟.
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸.
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤.
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置.
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解.
步骤6:滴定:用0.1000mol?L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL.反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式:
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol?L-1,pH≥
5
5
;(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程).