摘要:4.下列有关概念的判断依据的说法中正确的是 A.氧化还原反应:是否有化学键的断裂与形成 B.强电解质:水溶液或熔化状态下是否导电 C.离子反应:反应中是否有离子参加或生成 D.中和反应:反应中是否有水生成
网址:http://m.1010jiajiao.com/timu3_id_407991[举报]
(2013?崇明县一模)下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
(1)写出a的原子的最外层电子排布式
(2)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是
(3)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序:
(4)下列能用作f和g元素非金属性强弱比较的判断依据的是…
A.单质熔点:g<f
B.最高价氧化物对应水化物的酸性:g>f
C.最高价氧化物对应水化物的溶解性:g>f
D.f不能与氢气反应,g能与氢气反应.
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | j | k |
2s22p3
2s22p3
,a的原子最外层有3
3
个未成对电子.(2)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是
HClO4
HClO4
;最强碱与两性氢氧化物反应的化学方程式为:KOH+Al(OH)3=KAlO2+2H2O
KOH+Al(OH)3=KAlO2+2H2O
.(3)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序:
S2->Cl->K+
S2->Cl->K+
(用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是F-+H2O?HF+OH-
F-+H2O?HF+OH-
(用离子方程式表示).(4)下列能用作f和g元素非金属性强弱比较的判断依据的是…
BD
BD
A.单质熔点:g<f
B.最高价氧化物对应水化物的酸性:g>f
C.最高价氧化物对应水化物的溶解性:g>f
D.f不能与氢气反应,g能与氢气反应.
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
a |
|
b |
|
|
3 |
c |
d |
e |
f |
|
g |
h |
|
|
4 |
J |
|
|
|
|
|
k |
|
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点:
B.最高价氧化物对应水化物的酸性:
C.最高价氧化物对应水化物的溶解性:
D.f不能与氢气反应,g能与氢气反应
查看习题详情和答案>>
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城 市煤气等,市场前景极为广阔。它清洁,高效,具有优良的环保性能。 工业上制二甲醚是在一定温度(230~ 280℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应。
CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ . mol-1①
CH3OH(g) △H1=-90.7 kJ . mol-1①
2CH3OH(g)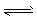 CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ②
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ②
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③
CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③
(1)反应器中的总反应可表示为3CO(g)+3H2(g)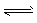 CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。
(2)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)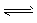 CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。
CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。
A.容器内混合气体的密度不变
B.容器内混合气体的压强保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2的同时消耗1 mol二甲醚
(3)二甲醚气体的燃烧热为1 455 kJ.mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。 下列有关叙述正确的是____。
A.二甲醚分子中含共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚与乙醇互为同系物
D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1 455 kJ.mol-1
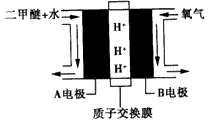
(4)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为___(填A电极或B电极),写出A电极的电极反应式:___ 。
CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7 kJ . mol-1①
CH3OH(g) △H1=-90.7 kJ . mol-1① 2CH3OH(g)
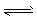 CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ②
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ② CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③
CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③(1)反应器中的总反应可表示为3CO(g)+3H2(g)
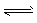 CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。(2)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)
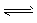 CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。
CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。 A.容器内混合气体的密度不变
B.容器内混合气体的压强保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2的同时消耗1 mol二甲醚
(3)二甲醚气体的燃烧热为1 455 kJ.mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。 下列有关叙述正确的是____。
A.二甲醚分子中含共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚与乙醇互为同系物
D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1 455 kJ.mol-1
(4)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为___(填A电极或B电极),写出A电极的电极反应式:___ 。