摘要:8.把10 mL密度为1.68 g/cm3的液态S2Cl2 溶于石油醚中配制成100 mL溶液.把该溶液慢慢加入50 mL3.2mol/L的SO2水溶液中.振荡使之充分反应.当加入的S2Cl2溶液为64.3 mL时.好反应完全.生成物用含0.32 mol KOH的KOH溶液中和后.恰好完全转化为KCl和一种二元含氧酸的钾盐晶体.试通过计算确定S2Cl2与SO2在溶液中反应的化学方程式.
网址:http://m.1010jiajiao.com/timu3_id_407576[举报]
实验室中只有10%、密度为1.05 g·mL-1的盐酸和38%、密度为1.19 g·mL-1的盐酸。今欲配制6 mol·L-1的盐酸,配制时应取38%的HCl和10%的盐酸的体积比是(假设混合后,体积不变化)_______。
查看习题详情和答案>>
现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况).
(1)该反应的离子方程式为
(2)则选用所贴标签为2.0mol?L-1的氢氧化钠,至少需该氢氧化钠溶液
(3)如选用所贴标签为10%(密度为1.043g?mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸
查看习题详情和答案>>
(1)该反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(2)则选用所贴标签为2.0mol?L-1的氢氧化钠,至少需该氢氧化钠溶液
200
200
毫升.(3)如选用所贴标签为10%(密度为1.043g?mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸
140.0
140.0
毫升(保留小数点后一位).
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200 mL密度为
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式__________________________。
(3)如图,组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
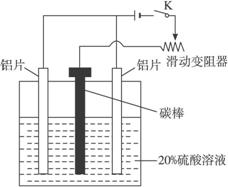
阳极__________________________;
阴极___________________________。
查看习题详情和答案>>