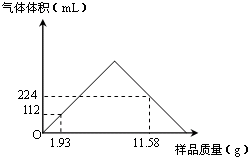
摘要:42.答案:130mL 解析:由图可知.NaOH.MgCl2.AlCl3三种固体溶于水时.NaOH过量.0.58g沉淀为Mg(OH)2.10mL盐酸用于中和过量NaOH.30mL-10mL=20mL盐酸和AlO2-反应生成Al(OH)3,最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀. 解:(1)由 MgCl2+2NaOH===Mg(OH)2↓+2NaCl 0.02mol NaOH + HCl == NaCl + H2O 0.005mol 0.01L×0.5mol/L AlO2- + H+ + H2O == Al(OH)3↓ 0.01mol 0.02L×0.5mol/L 0.01mol AlCl3 + 4NaOH == NaAlO2 + 3NaCl 0.01mol 0.04mol 0.01mol 由上述可知.n=0.02mol+0.005mol+0.04mol=0.065mol 所以m=0.065mol×40g/mol=2.6g 可知.n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g (3)由图知:P点溶液的溶质为NaCl.AlCl3.MgCl2.相当于用盐酸中和了原溶液中的NaOH所得的结果.所以n=0.065mol.
网址:http://m.1010jiajiao.com/timu3_id_407483[举报]
下图是某医院输液用的一瓶葡萄糖注射液标签的部分内容。据此回答以下问题(答案保留2位小数):
(1)该葡萄糖溶液的物质的量浓度为______mol·L-1。
(2)已知葡萄糖在人体组织中发生缓慢氧化,提供生命活动所需要的能量:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H=-2804kJ·mol-1则该瓶葡萄糖注射液大约可为病人提供______kJ的热量。

查看习题详情和答案>>
(6分)下图是某医院输液用的一瓶葡萄糖注射液标签的部分内容。据此回答以下问题(答案保留2位小数):
(1)该葡萄糖溶液的物质的量浓度为 mol·L-1。
(2)已知葡萄糖在人体组织中发生缓慢氧化,提供生命活动所需要的能量:
C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l)
?H=" -2804" kJ?mol-1。则该瓶葡萄糖注射液大约可为病人提供 kJ的热量。
解答过程:
下图是某医院输液用的一瓶葡萄糖注射液标签的部分内容。据此回答以下问题(答案保留2位小数):
(1)该葡萄糖溶液的物质的量浓度为______mol·L-1。
(2)已知葡萄糖在人体组织中发生缓慢氧化,提供生命活动所需要的能量:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H=-2804kJ·mol-1则该瓶葡萄糖注射液大约可为病人提供______kJ的热量。
 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途.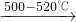 2BaO2.现有16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨.那么实际参加反应的氧化钡的质量为______吨.
2BaO2.现有16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨.那么实际参加反应的氧化钡的质量为______吨.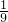 ,求该反应条件下混合气体的平均式量?
,求该反应条件下混合气体的平均式量?